题目内容
【题目】几种短周期元素的原子半径和主要化合价见下表,下列说法中正确的是( )
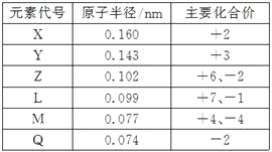
A. 等物质的量的X、Y的单质与足量的盐酸反应,生成的H2一样多
B. Y与Q形成的化合物不能跟氢氧化钠溶液反应
C. 在化学反应中,M原子与其他原子易形成共价键而不易形成离子键
D. Z的氢化物的稳定性强于L的氢化物的稳定性
【答案】C
【解析】
短周期元素,由元素的化合价可知,Q只有-2价,则Q为O元素,Z有+6、-2价,可知Z为S元素;L有+7、-1价,则L为氯元素;M有+4、-4价,原子半径L>M,则M为C元素;X为+2价,Y为+3价,原子半径X>Y>Z,所以X为Mg元素,Y为Al元素。
A.X为Mg元素,Y为Al元素,等物质的量的X、Y的单质与足量盐酸反应,根据电子转移守恒可知,二者生成H2为2:3,故A错误;
B.Y与Q形成的化合物为Al2O3,氧化铝是两性氧化物,与氢氧化钠溶液反应生成偏铝酸钠,故B错误;
C. M为C元素,最外层电子数为4,电子不易得失,与其它原子易形成共价键而不易形成离子键,故C正确;
D. 非金属性Cl>S,所以稳定性HCl>H2S,即L的氢化物的稳定性强于Z的氢化物的稳定性,故D错误;
答案选C。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】下列有关实验操作、现象和解释或结论都正确的是
选项 | 实验操作 | 现象 | 解释或结论 |
A | 过量的Fe粉中加入HNO3, | 溶液呈红色 | 稀HNO3将Fe氧化为 |
B | AgI沉淀中滴入稀KCl溶液 | 有白色沉淀出现 | AgCl比AgI更难溶 |
C | Al箔插入稀HNO3中 | 无现象 | Al箔表面被HNO3氧化,形成致密的氧化膜 |
D | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |