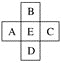
题目内容
【题目】用惰性电极电解一定浓度的CuSO4溶液时,通电一段时间后,向所得的溶液中加入0.1 mol Cu2(OH)2CO3后恰好恢复到电解前的浓度和pH (不考虑二氧化碳的溶解)。则电解过程中转移的电子的物质的量为( )
A. 0.4 molB. 0.5 molC. 0.6 molD. 0.8 mol
【答案】C
【解析】
根据电解硫酸铜的原理:第一阶段:2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4,第二阶段:2H2O
2Cu+O2↑+2H2SO4,第二阶段:2H2O![]() 2H2↑+O2↑,根据所加入的Cu2(OH)2CO3的量根据电极反应来计算即可。
2H2↑+O2↑,根据所加入的Cu2(OH)2CO3的量根据电极反应来计算即可。
电解硫酸铜时,初阶段:2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4,后阶段:2H2O
2Cu+O2↑+2H2SO4,后阶段:2H2O![]() 2H2↑+O2↑,如果只按照第一阶段的电解,反应只需要加入CuO或CuCO3就可以,但是现在加入的是Cu2(OH)2CO3,相当于多加入了一个水(0.1molH2O),这0.1mol的水,应该是第二阶段的反应进行,该阶段转移了0.2mol电子,第一阶段转移了0.4mol电子,所以总共转移电子0.6mol,故C正确;
2H2↑+O2↑,如果只按照第一阶段的电解,反应只需要加入CuO或CuCO3就可以,但是现在加入的是Cu2(OH)2CO3,相当于多加入了一个水(0.1molH2O),这0.1mol的水,应该是第二阶段的反应进行,该阶段转移了0.2mol电子,第一阶段转移了0.4mol电子,所以总共转移电子0.6mol,故C正确;
答案选C。

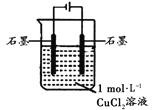
【题目】某小组同学利用下图装置对电解氯化铜实验进行了研究。
装置 | 现象 |
| 电解一段时间时,阳极石墨表面产生气体,阴极石墨上附着红色物质,溶液由蓝色变为绿色 |
(1)甲认为电解过程中阳极产生的_________是溶液变绿的原因,写出产生该物质的电极反应式:_________________________。
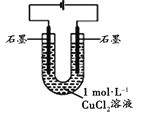
(2)乙改用下图装置,在相同条件下电解CuCl2溶液,对溶液变色现象继续探究。
装置 | 现象 |
| 电解相同时间时,阳极石墨表面产生气泡,溶液仍为蓝色;阴极石墨上附着红色物质,溶液由蓝色变为绿色; |
乙通过对现象分析证实了甲的观点不是溶液变绿的主要原因。乙否定甲的依据是______________。
(3)乙继续查阅资料:
i. 电解CuCl2溶液时可能产生[CuCl2]--,[CuCl2]- 掺杂Cu2+ 后呈黄色
ii. 稀释含[CuCl2]- 的溶液生成CuCl白色沉淀,据此乙认为:电解过程中,产生[CuCl2]_掺杂Cu2+后呈黄色,与CuCl2蓝色溶液混合呈绿色。
乙进行如下实验:
a.取电解后绿色溶液2 mL,加20 mL水稀释,静置5分钟后溶液中产生白色沉淀。
b. 另取少量氯化铜晶体和铜粉,向其中加2 mL浓盐酸,加热获得含[CuCl2]_的黄色溶液。
c. 冷却后向上述溶液……
d. 取c中2 mL溶液,加20 mL水稀释,静置5分钟后溶液中产生白色沉淀。
① a的目的是__________________________________________。
② 写出b中生成[CuCl2]- 的离子方程式:____________________________________________。
③ 补充c中必要的操作及现象:____________________________________________。
乙据此得出结论:电解时阴极附近生成[CuCl2]- 是导致溶液变绿的原因。