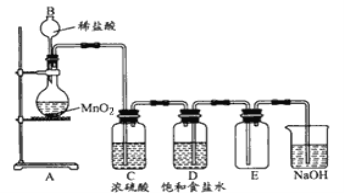
题目内容
【题目】某溶液X中可能含有下列离子中的若干种:Cl-、![]() 、
、![]() 、
、![]() 、Na+、Mg2+、Fe3+,为了确定该溶液的组成,某同学取100mL上述溶液X,进行了如下实验(必要时可加热),下列说法不正确的是
、Na+、Mg2+、Fe3+,为了确定该溶液的组成,某同学取100mL上述溶液X,进行了如下实验(必要时可加热),下列说法不正确的是
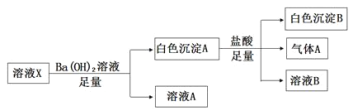
A.气体A可能是CO2或SO2
B.溶液X中一定存在![]()
C.溶液X中一定不存在Fe3+和Mg2+,可能存在Na+
D.向溶液A加入硝酸酸化的硝酸银溶液可能生成白色沉淀
【答案】C
【解析】
溶液与Ba(OH)2反应生成白色沉淀,则一定不含Fe3+,且产生的白色沉淀与足量盐酸反应,沉淀部分溶解且产生气体,则白色沉淀一定有BaSO4,一定存在SO42-、HCO3-或SO32-中的至少一种,气体为CO2或SO2:①若气体A是CO2,则溶液中一定存在SO42-、HCO3-,可能还含有Cl-、Na+、Mg2+(Na+、Mg2+至少存在一种);②若气体A是SO2,则溶液中一定存在SO42-、SO32-,由于SO32-和Mg2+不共存,则溶液中一定存在SO42-、SO32-、Na+,可能还含有Cl-,一定不存在Mg2+、HCO3-;③若气体A是CO2、SO2的混合气体,则溶液中一定存在SO42-、SO32-、HCO3-、Na+,可能还含有Cl-,一定不存在Mg2+,据此分析解答。
溶液与Ba(OH)2反应生成白色沉淀,则一定不含Fe3+,且产生的白色沉淀与足量盐酸反应,沉淀部分溶解且产生气体,则白色沉淀一定有BaSO4,一定存在SO42-、HCO3-或SO32-中的至少一种,气体为CO2或SO2:①若气体A是CO2,则溶液中一定存在SO42-、HCO3-,可能还含有Cl-、Na+、Mg2+(Na+、Mg2+至少存在一种);②若气体A是SO2,则溶液中一定存在SO42-、SO32-,由于SO32-和Mg2+不共存,则溶液中一定存在SO42-、SO32-、Na+,可能还含有Cl-,一定不存在Mg2+、HCO3-;③若气体A是CO2、SO2的混合气体,则溶液中一定存在SO42-、SO32-、HCO3-、Na+,可能还含有Cl-,一定不存在Mg2+;
A.溶液与Ba(OH)2反应生成白色沉淀,白色沉淀与足量盐酸反应,沉淀部分溶解且产生气体,则白色沉淀为BaSO4、BaSO3或BaCO3的混合物,气体为CO2或SO2,故A正确;
B.溶液与Ba(OH)2反应生成白色沉淀,白色沉淀与足量盐酸反应,沉淀部分溶解,则白色沉淀一定含有BaSO4,即溶液X中一定存在SO42-,故B正确;
C.溶液与Ba(OH)2反应生成白色沉淀,则一定不含Fe3+,若溶液由SO42-、HCO3-、Na+、Mg2+或Cl-构成,则仍与实验现象吻合,所以Mg2+可能含有,故C错误;
D.由上述分析可知,溶液中可能含有Cl-,所以向溶液1(无SO42-)加入硝酸酸化的硝酸银溶液可能生成AgCl白色沉淀,故D正确;
故答案为C。

 名校课堂系列答案
名校课堂系列答案【题目】苯甲酸广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸。
Ⅰ.制备苯甲酸和回收未反应的甲苯
反应原理:

第1步:一定量的甲苯和KMnO4溶液在100℃反应一段时间后停止反应;
第2步:过滤反应混合物,得到滤液;经过操作Ⅰ,得到有机层和水层;
第3步:向有机层中加无水Na2SO4,过滤,经过操作Ⅱ,得到无色液体A;
第4步:向水层加入浓盐酸酸化,蒸发浓缩,冷却,过滤,得到白色固体B;
已知:
相对分子质量 | 熔点 | 沸点 | 密度 | 溶解度 | |
甲苯 | 92 | -95℃ | 110.8℃ | 0.8669g·mL-1 | 极微溶于水 |
苯甲酸 | 122 | 122.4℃ | 249℃ | 1.2659 g·mL-1 | 0.3g (25℃时) 6.9g (95℃时) |
(1)操作Ⅰ所用的玻璃仪器有烧杯和______________,操作Ⅱ为________________。
(2)第3步中加入无水Na2SO4的目的是_____________________,无色液体A是_______。
Ⅱ.提纯粗苯甲酸
(3)该同学利用重结晶的方法对得到的B进行提纯。重结晶的过程:__________→_________ →_______ →抽滤(与过滤类似)→洗涤→干燥→纯苯甲酸。(注:抽滤装置如图所示,主要仪器有A布氏漏斗,B抽滤瓶,抽气泵等)

(4)白色固体B中的杂质是____________。
(5)趁热抽滤得到的滤液放置冷却可以结晶出纯净的苯甲酸晶体,为了得到更多的苯甲酸,是不是温度越低越好并说明理由______(填“是”或“不是”),理由___________________________________________。