题目内容
(10分)榴石矿石可以看作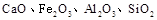 组成,由榴石矿石制取氯化钙和氧化铝的实验步骤如下:
组成,由榴石矿石制取氯化钙和氧化铝的实验步骤如下:
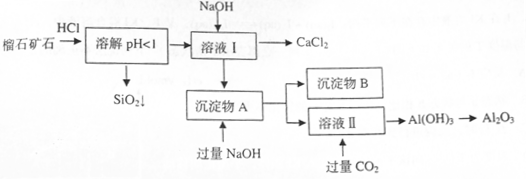
(1)榴石矿加盐酸溶解后,溶液里除了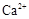 外,还含有的金属离子是 。
外,还含有的金属离子是 。
(2)对溶液I进行操作时,控制溶液PH=9~10(有关氢氧化物沉淀的PH见下表)
NaOH不能过量,若NaOH过量可能会导致 溶解, 沉淀。

(3)写出向沉淀物A中加入过量氢氧化钠溶液的离子方程式 。
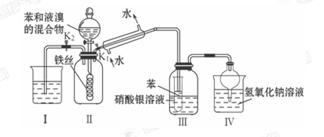
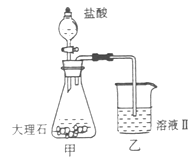
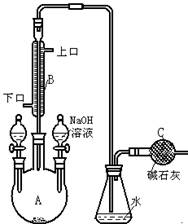
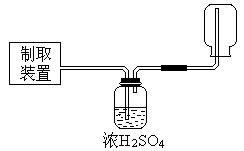
(4)①某同学在实验室中用图I装置制取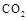 气体并通入溶液II中,结果没有沉淀产生,可能的原是 ;为了能产生沉淀该同学对图I装置进行了改进,改进的方法为 。
气体并通入溶液II中,结果没有沉淀产生,可能的原是 ;为了能产生沉淀该同学对图I装置进行了改进,改进的方法为 。
②若将二氧化碳气体通入澄清石灰水中,石灰水变浑浊,混合体系中除存在电离平衡、水解平衡外,还存在溶解平衡,用方程式表示该溶解平衡关系 。
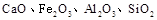 组成,由榴石矿石制取氯化钙和氧化铝的实验步骤如下:
组成,由榴石矿石制取氯化钙和氧化铝的实验步骤如下:
(1)榴石矿加盐酸溶解后,溶液里除了
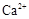 外,还含有的金属离子是 。
外,还含有的金属离子是 。(2)对溶液I进行操作时,控制溶液PH=9~10(有关氢氧化物沉淀的PH见下表)
NaOH不能过量,若NaOH过量可能会导致 溶解, 沉淀。

(3)写出向沉淀物A中加入过量氢氧化钠溶液的离子方程式 。
(4)①某同学在实验室中用图I装置制取
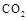 气体并通入溶液II中,结果没有沉淀产生,可能的原是 ;为了能产生沉淀该同学对图I装置进行了改进,改进的方法为 。
气体并通入溶液II中,结果没有沉淀产生,可能的原是 ;为了能产生沉淀该同学对图I装置进行了改进,改进的方法为 。
②若将二氧化碳气体通入澄清石灰水中,石灰水变浑浊,混合体系中除存在电离平衡、水解平衡外,还存在溶解平衡,用方程式表示该溶解平衡关系 。
(10分)
(1)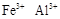 (2分)
(2分)
(2)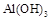 (1分)
(1分)  (1分)
(1分)
(3) (2分)
(2分)
(4)①盐酸挥发,制取的二氧化碳中含有盐酸(1分) 在甲与乙之间加一盛有饱和碳酸氢钠溶液的洗气瓶(1分) ②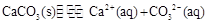 (2分)
(2分)
(1)
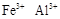 (2分)
(2分)(2)
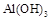 (1分)
(1分)  (1分)
(1分)(3)
 (2分)
(2分)(4)①盐酸挥发,制取的二氧化碳中含有盐酸(1分) 在甲与乙之间加一盛有饱和碳酸氢钠溶液的洗气瓶(1分) ②
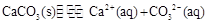 (2分)
(2分)(1)榴石矿加盐酸后溶液中金属离子有:Ca2+、Fe3+、AL3+,SiO2不溶于盐酸;
(2)向溶液I中加入NaOH溶液,NaOH不能过量,若NaOH过量可能会导致AL(OH)3溶解,氢氧化铝为典型的两性氢氧化物,同时可能会生成Ca(OH)2沉淀。控制溶液PH=9~10的目的是使Fe3+、AL3+变为沉淀,而Ca2+则不能生成沉淀。
(3)写出向沉淀物A中加入过量氢氧化钠溶液,其中氢氧化铝会与氢氧化钠溶液反应,而氢氧化铁沉淀则不溶于氢氧化钠溶液。其反应的离子方程式为: 或AL(OH)3+OH—=ALO2—+2H2O;
或AL(OH)3+OH—=ALO2—+2H2O;
(4)①大理石与稀盐酸反应生成的二氧化碳气体中混有HCL、水蒸气等杂质气体,要使澄清石灰水能变浑浊只需将二氧化碳气体中的HCL气体除去,可将混合气体通入盛有饱和碳酸氢钠的洗气瓶中。
②石灰水变浑浊是生成了碳酸钙,其溶解平衡表达式为:CaCO3(s)?Ca2+(aq)+2OH—(aq)
(2)向溶液I中加入NaOH溶液,NaOH不能过量,若NaOH过量可能会导致AL(OH)3溶解,氢氧化铝为典型的两性氢氧化物,同时可能会生成Ca(OH)2沉淀。控制溶液PH=9~10的目的是使Fe3+、AL3+变为沉淀,而Ca2+则不能生成沉淀。
(3)写出向沉淀物A中加入过量氢氧化钠溶液,其中氢氧化铝会与氢氧化钠溶液反应,而氢氧化铁沉淀则不溶于氢氧化钠溶液。其反应的离子方程式为:
 或AL(OH)3+OH—=ALO2—+2H2O;
或AL(OH)3+OH—=ALO2—+2H2O;(4)①大理石与稀盐酸反应生成的二氧化碳气体中混有HCL、水蒸气等杂质气体,要使澄清石灰水能变浑浊只需将二氧化碳气体中的HCL气体除去,可将混合气体通入盛有饱和碳酸氢钠的洗气瓶中。
②石灰水变浑浊是生成了碳酸钙,其溶解平衡表达式为:CaCO3(s)?Ca2+(aq)+2OH—(aq)

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 +Br+→[
+Br+→[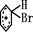 ];[
];[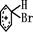 ]+FeBr4-→
]+FeBr4-→ +HBr+FeBr3;
+HBr+FeBr3; +Br2→
+Br2→ +HBr中的催化剂为( )
+HBr中的催化剂为( )
 8分,每空2分)
8分,每空2分)