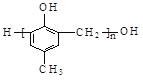题目内容
【题目】(1)①CH3COONa溶液呈碱性,原因是____________________(用化学用语表达)。
②在CH3COONa溶液中,各个离子浓度大小关系为_________________________
③写出碳酸钠溶液中电荷守恒关系式_________________________________________
(2)已知:C(s)+H2O(g)![]() CO(g)+H2(g) △H=+131.3kJ/mol。
CO(g)+H2(g) △H=+131.3kJ/mol。
①该反应是________(填“吸热”或“放热”)反应。
②它若反应消耗24gC(s),则反应吸收的热量为___________。
(3)在一定温度下,将CO(g)和H2O(g)各0.16mol通入容积为2.0L的恒容密闭容器中,发生反应CO(g)+H2O(g)![]() CO2(g)+H2(g),得到下表中数据:
CO2(g)+H2(g),得到下表中数据:
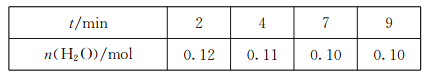
①2min内,v(CO)=________。
②该温度下,此反应的平衡常数的值是________。
③其他条件不变,再充入0.1molCO和0.molH2O(g),达到平衡时CO的体积分数_____(填“增大”“减小”或“不变”)。
(4)下图为直流电源电解CuSO4溶液的装置,C1和C2都为石墨电极。请回答下列问题:
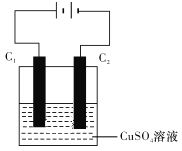
①C1作______(填“阳极”或“阴极”)。
②C2电极的电极反应式为___________。
③惰性电极电解CuSO4溶液的化学方程式是_________________________
【答案】CH3COO-+ H2O CH3COOH+ OH- c(Na+)>c(CH3COO-)>c(OH-)>c(H+) c(Na+)+ c(H+)= c(OH-)+ c(HCO3 -)+2c(CO3 2-) 吸热 262.6kJ 0.01mol/(Lmin) 0.36 不变 阳极 Cu2++2e-=Cu 2CuSO4+2 H2O![]() 2Cu+ O2↑+ H2SO4
2Cu+ O2↑+ H2SO4
【解析】
(1)①CH3COOH为弱酸,CH3COONa溶液呈碱性,是由于CH3COO-发生水解;②在CH3COONa溶液中,CH3COO-发生水解,溶液呈碱性,据此分析排序;③碳酸钠溶液中碳酸根离子发生水解,溶液中存在Na+、HCO3 -、CO3 2-、H+、OH-和H2CO3,据此书写电荷守恒关系式;
(2)①反应的焓变△H>0,据此判断反应的热效应;②根据热化学方程式计算;
(3)①根据表格数值计算2min内,H2O的消耗速率,再由化学反应速率之比等于化学计量数之比计算CO的消耗速率;②根据三段式结合K= 计算;③其他条件不变,再充入0.1molCO和0.molH2O(g),相当于对反应加压,不改变化学平衡状态;
计算;③其他条件不变,再充入0.1molCO和0.molH2O(g),相当于对反应加压,不改变化学平衡状态;
(4)①根据电解池装置分析,C1电极连接外电路正极;②C2为电解池阴极,发生还原反应,电解CuSO4溶液,则溶液中Cu2+被还原为Cu;③用惰性电极电解硫酸铜溶液时,阳极上氢氧根离子放电、阴极上铜离子放电,电解生成金属铜,硫酸和氧气。
(1)①CH3COOH为弱酸,CH3COONa溶液呈碱性,是由于CH3COO-发生水解,CH3COO-+ H2O CH3COOH+ OH-,故答案为:CH3COO-+ H2O CH3COOH+ OH-;
②在CH3COONa溶液中,CH3COO-发生水解,Na+不水解,溶液呈碱性,所以溶液中c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故答案为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+);
③碳酸钠溶液中碳酸根离子发生水解,Na+不水解,溶液中存在Na+、HCO3 -、CO3 2-、H+、OH-和H2CO3,因此电荷守恒关系式为c(Na+)+ c(H+)= c(OH-)+ c(HCO3 -)+2c(CO3 2-),故答案为:c(Na+)+ c(H+)= c(OH-)+ c(HCO3 -)+2c(CO3 2-);
(2)①C(s)+H2O(g)![]() CO(g)+H2(g) △H=+131.3kJ/mol,△H>0,为吸热反应,故答案为:吸热;
CO(g)+H2(g) △H=+131.3kJ/mol,△H>0,为吸热反应,故答案为:吸热;
②若反应消耗24gC(s),即消耗2molC(s),根据C(s)+H2O(g) CO(g)+H2(g) △H=+131.3kJ/mol,应吸热2×131.3kJ=262.6kJ,故答案为:262.6kJ;
(3)①根据表中数据,2min内,H2O的消耗速率为v(H2O)=![]() =0.01mol/(Lmin),由化学反应速率之比等于化学计量数之比,则v(CO)=v(H2O)=0.01mol/(Lmin),故答案为:0.01mol/(Lmin);
=0.01mol/(Lmin),由化学反应速率之比等于化学计量数之比,则v(CO)=v(H2O)=0.01mol/(Lmin),故答案为:0.01mol/(Lmin);
②根据表中数据,平衡是水为0.1mol,浓度为![]() =0.05mol/L
=0.05mol/L
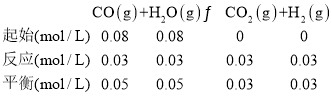
化学平衡常数表达式为生成物的浓度次幂与反应物的浓度次幂之比,化学平衡常数表达式为K= =
=![]() =0.36,故答案为:0.36;
=0.36,故答案为:0.36;
③其他条件不变,再充入0.1molCO和0.1molH2O(g),相当于对反应体系加压,增大压强,CO(g)+H2O(g)![]() CO2(g)+H2(g)平衡不移动,所以达到平衡时CO的体积分数不变,故答案为:不变;
CO2(g)+H2(g)平衡不移动,所以达到平衡时CO的体积分数不变,故答案为:不变;
(4)①根据电解池装置,C1电极连接外电路正极,则C1电极为电解池阳极,故答案为:阳极;
②C2为电解池阴极,发生还原反应,电解CuSO4溶液,溶液中Cu2+被还原为Cu,电极反应式为:Cu2++2e-=Cu,故答案为:Cu2++2e-=Cu;
③用惰性电极电解硫酸铜溶液时,阳极上氢氧根离子放电生成氧气、阴极上铜离子放电生成Cu,化学方程式为2CuSO4+2H2O ![]() 2Cu+O2↑+2H2SO4,故答案为:2CuSO4+2H2O
2Cu+O2↑+2H2SO4,故答案为:2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4。
2Cu+O2↑+2H2SO4。