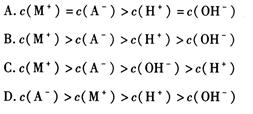题目内容
甲酸为一元弱酸,在15mL0.1mol/L KOH溶液中逐滴加入0.2mol/L甲酸溶液,溶液的pH变化和所加入的甲酸的体积关系描绘成如图所示曲线。下面有关微粒浓度的大小关系正确的是
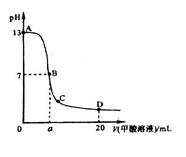
A.在A、B间的任意一点上都存在: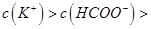
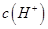
B.在B点: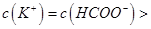
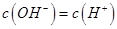 ,且a=7.5
,且a=7.5
C.在C点: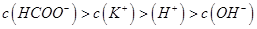
D.在D点: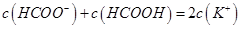

A.在A、B间的任意一点上都存在:
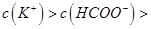
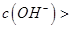
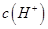
B.在B点:
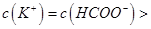
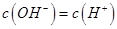 ,且a=7.5
,且a=7.5C.在C点:
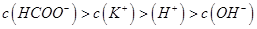
D.在D点:
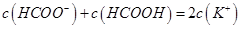
C
试题分析:A、在A、B间任意一点,因为开始时c(OH-)>c(HCOO-),也有可能是c(K+)>c(OH-)>c(HCOO-)>c(H+),错误;B、当恰好中和时消耗0.2mol?L?1甲酸溶液7.5mL,因为HCOOK水解显碱性,欲显中性,则有a>7.5,错误;C、C点甲酸过量,溶液呈酸性,c(HCOO?)>c(K+)>c(H+)>c(OH-),正确;D、D点甲酸过量,所加入甲酸的物质的量为0.02L×0.2mol/L═0.004mol,KOH的物质的量为0.015L×0.1mol/L=0.0015mol,则反应后c(HCOO-)+c(HCOOH)>2c(K+),错误。

练习册系列答案
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案
相关题目
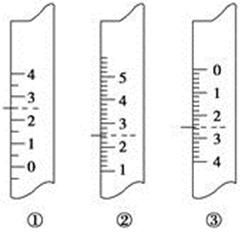
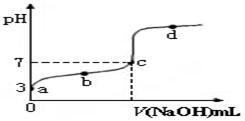
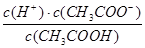 均等于K
均等于K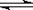 H+ + OH-。下列叙述中,正确的是
H+ + OH-。下列叙述中,正确的是