��Ŀ����
����Ŀ��25 ��ʱ����Ũ��Ϊ0.1000 mol��L��1��NaOH��Һ�ζ�25.00 mLŨ�Ⱦ�Ϊ0.1000 mol��L��1��������HX��HY��HZ���ζ�������ͼ��ʾ������˵����ȷ���ǣ�
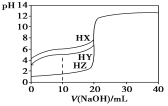
A������ͬ�¶��£�ͬŨ�ȵ���������Һ�ĵ�������˳��HZ��HY��HX
B�����ݵζ����ߣ��ɵ�Ka(HY)��1��10��5
C��������HX��HY��Һ�������Ϻ���NaOH��Һ�ζ���HXǡ����ȫ��Ӧʱ��
c(X��)��c(Y��)��c(OH��)��c(H��)
D��HY��HZ��ϣ��ﵽƽ��ʱc(H��)��![]() ��c(Z��)��c(OH��)
��c(Z��)��c(OH��)
���𰸡�B
��������
���������Ũ����ͬʱ����Խ��������̶�ԽС�����������H+Ũ��ԽС��PHԽ����δ����NaOH��֪������HZ��pH=1��HZ��ǿ�ᣬ��HY��HX��pH������1���������������ᣬ������HY��HX���ʵ�������ΪHZ��HY��HX��A��������HY��˵����ͼ֪��δ��NaOHʱ��c��H+��=10-3mol/L����HY��Ka����Ϊ10��3��10��3/0.1=10-5��B��ȷ����ǡ�á��кͣ�����HY����ǿ��HX������X-ˮ��̶ȴ���Y-��C����HY��HZ��ϣ���Һ�ĵ���غ�ʽΪ��c(H+)= c(Y��)+ c(Z��)+c(OH��)���ָ���HY�ĵ���ƽ�ⳣ����Ka(HY)=c(H+)c(Y-)/c(HY)��c(Y-)=Ka(HY)c(HY)/c(H+)����������ɵ�ʽ���ɵ�c(H+)= c(Y-)Ka(HY)c(HY)/c(H+)+c(Z-)+c(OH-)��D������ѡB��

����Ŀ���˿���Դ����ίԱ�ḱ���Ρ��й���ѧԺԺʿ�ش�ӱ�ʾ����ǰ�����ɢ��ú��û������ú������й������������߶�����������Ҫԭ��ú�������ǽ����������������ú̿����Ҫ;��֮һ��
����֪:H2O(g)=H2O(I) ��H=-44kJ/mol
���� | H2(g) | C(s) | CO(g) |
ȼ����kJ/mol | -285.8 | -393.5 | -283.0 |
����д��ú��������Ӧ���ɺϳ���(CO��H2)���Ȼ�ѧ����ʽ___________��
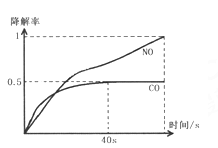
���ں��¡����ݵķ�Ӧ���У��ܱ���������Ӧ�ﵽƽ��״̬����_______��
a.�������ƽ����Է����������ٸı�
b.����ѹǿ���ٸı�
c.������Ũ�����
d.��Ӧ��ϵ���¶ȱ��ֲ���
e.���������������Ƕ�����������ʵ�2��
f.��������ܶȲ���
g.��λʱ���ڣ�����ˮ������������������������Ϊ9��1
���ڴ��������ºϳ����ϳɼ�������лᷢ�����·�Ӧ��
I CO(g)+3H2(g) = CH4(g)+H2O(g) ��H1= -206 kJ/mol
II CO(g)+H2O(g) = CO2(g)+H2(g) ��H2= -41 kJ/mol
�� 2CO(g)+2H2(g)= CH4(g)+CO2(g) ��H 3= -247.4 kJ/mol
��ͼ1��̫ԭ������ѧú�����о�����������ѧ���ݷ����õ��¶ȶԷ�Ӧ��InK(��ѧƽ�ⳣ��K����Ȼ����)������ͼ,����������������Ƶ�ԭ����____________��

������鷴Ӧѡ���ԵĹؼ�������_______���������֪ʶ��ͼ2�����ϳɼ������˵ķ�Ӧ������
��550��630K��1MPa��ԭ����__________________��
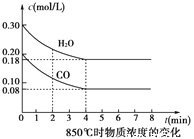
��850��ʱ�����Ϊ5L��Ӧ���з�����Ӧ��CO��H2O(g)Ũ�ȱ仯��ͼ��ʾ������ʽ����������µ�ƽ�ⳣ��_____________ ��
(3)CH4ȼ�ϵ�������ʺܸߣ�װ��������1L2mol/L��KOH��ҺΪ����ʣ���������ͨ���״���¼���22.4L��33.6 Lʱ�����缫��ӦΪ___________��