题目内容
19.现有四组物质:①O2 N2 Cu Si ②HCl HBr H2S HNO3③CaO Na2O CuO Al2O3
④NH4Cl NaOH NaAlO2 K2CO3
(1)填写下表空白:
| 组 | ①组 | ②组 | ③组 | ④组 |
| 分类标准 | 非金属 | 无氧酸 | 碱性氧化物 | |
| 异类物质 | NaOH |
A 树状分类法 B 交叉分类法
(3)若表中①②组物质反应生成0.6molNO,则转移的电子数目为0.18NA.起酸性作用的HNO3物质的量为1.8mol.
(4)写出表中③④组物质反应的离子方程式:Al2O3+2OH-=2AlO2-+H2O.
分析 (1)根据元素的名称偏旁来判断元素的类别,根据酸中是否含有氧元素确定是不是含氧酸,碱性氧化物是指能和碱反应生成盐和水的化合物,碱是指电离出的阴离子全部是氢氧根离子的化合物,据此回答;
(2)根据物质分类法知识结合树状分布图的特点来判断;
(3)根据金属铜和稀硝酸反应的方程式,结合生成NO的量、消耗硝酸的量、硝酸的作用以及电子转移知识来回答;
(4)氧化铝可以和氢氧化钠溶液反应生成偏铝酸钠溶液,据此回答.
解答 解:(1)①中只有Cu是金属元素,其余的是非金属元素组成的单质或是非金属元素原子构成的分子,②中只有HNO3属于酸中的含氧酸,③氧化铝既能和酸反应又能和碱反应生成盐和水,属于两性氧化物,不属于碱性氧化物,④中只有氢氧化钠属于碱类,其余的均属于盐类,故答案为:Cu;HNO3;Al2O3;NaOH;
(2)上题中的物质分类法属于交叉分类法,故选B;
(3)表中①②组物质反应为:3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O,生成2mol氮气,转移电子是6mol,当生成0.6molNO,则转移的电子0.18mol,数目为0.18NA,消耗硝酸的物质的量是2.4mol,显示酸性的硝酸是1.8mol,故答案为:0.18;1.8mol;
(4)氧化铝和氢氧化钠溶液反应生成偏铝酸钠(NaAlO2)和水,反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O.
点评 本题综合考查物质的分类知识以及物质的性质、方程式的书写、氧化还原反应中的电子转移知识,注意知识的归纳和梳理是关键,难度中等.

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案
相关题目
9.下列四个实验装置中,一定没有气体生成的是( )
| A. | 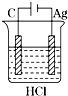 | B. |  | C. | 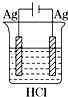 | D. |  |
14.如图所示,将铁棒和石墨棒插入1L 1mol•L-1食盐水中.下列说法正确的是( )
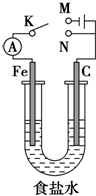

| A. | 若电键K与N连接,铁被保护不会腐蚀 | |
| B. | 若电键K与N连接,正极反应式是4OH--4e-═2H2O+O2↑ | |
| C. | 若电键K与M连接,将石墨棒换成铜棒,可实现铁棒上镀铜 | |
| D. | 若电键K与M连接,当C电极共产生11.2L(标准状况)气体时,生成了1 mol NaOH |
4.下列各组物质中,化学键类型完全相同的是( )
| A. | NH3和N2 | B. | H2O2和NH4Cl | C. | CO2和PCl3 | D. | H2S和Na2O2 |
8.下列化学反应的离子方程式书写正确的是( )
| A. | FeCl3溶液与Cu粉反应:Cu+2Fe3+═Cu2++2Fe2+ | |
| B. | 钠与水反应:Na+2H2O=Na++2OH-+H2↑ | |
| C. | 氯气与水反应:Cl2+H2O?2H++Cl-+ClO- | |
| D. | 氯化铝溶液与过量氨水反应:3NH3•H2O+Al3+=Al(OH)3↓+3NH4+ |
 根据图中A、B两种固体物质的溶解度曲线,回答下列问题:
根据图中A、B两种固体物质的溶解度曲线,回答下列问题:
 .
.
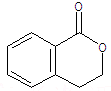 .②由F生成的G化学方程式
.②由F生成的G化学方程式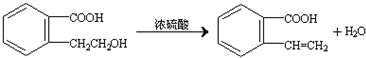 .
. .
.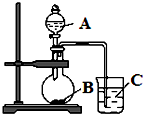 某研究性学习小组设计了一组实验,验证元素周期律.
某研究性学习小组设计了一组实验,验证元素周期律.