题目内容
2.下列有关反应的离子方程式书写正确的是( )| A. | 将Na加入CuSO4溶液中:Na+Cu2+=Cu+2Na+ | |
| B. | 将NaHSO4溶液加入Ba(OH)2溶液中至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O | |
| C. | 向氯化铝溶液中加入足量氨水:AI3++4NH3•H2O=AIO2-+2H2O+4NH4+ | |
| D. | 向Ca(OH2)溶液中通入过量SO2:SO2+OH-=HSO3- |
分析 A.钠与硫酸铜溶液的反应中,钠先与水反应,生成的氢氧化钠再与硫酸铜反应;
B.混合液为中性时,硫酸氢钠与氢氧化钡按照物质的量2:1反应;
C.一水合氨为弱碱,二者反应生成氢氧化铝沉淀和氯化铵;
D.二氧化硫过量,反应生成亚硫酸氢根离子.
解答 解:A.钠原子最外层只有一个电子,金属钠在反应中容易失电子,具有强还原性,金属钠和铜的盐溶液反应时,先是金属钠和水的反应,2Na+2H2O=2NaOH+H2↑,其次是生成的氢氧化钠和硫酸铜之间的反应2NaOH+CuSO4=Cu(OH)2↓+Na2SO4,有蓝色沉淀Cu(OH)2生成,Na不能把Cu2+置换出来,故A错误;
B.将NaHSO4溶液加入Ba(OH)2溶液中至中性,正确的离子方程式为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,故B错误;
C.向氯化铝溶液中加入足量氨水,反应生成氢氧化铝沉淀,正确的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故C错误;
D.Ca(OH2)溶液中通入过量SO2,反应生成亚硫酸钙,反应的离子方程式为:SO2+OH-=HSO3-,故D正确;
故选D.
点评 本题考查了离子方程式的书写判断,为中等难度的试题,注意掌握离子方程式正误判断常用方法:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式等.

练习册系列答案
相关题目
12.一定条件下用甲烷可以消除氮氧化物(NOx)的污染.已知:
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1 160kJ•mol-1
下列叙述正确的是( )
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1 160kJ•mol-1
下列叙述正确的是( )
| A. | CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(l)△H=-867 kJ•mol-1 | |
| B. | CH4催化还原NOx为N2的过程中,若x=1.6,则转移电子3.2 mol | |
| C. | 若0.2 mol CH4还原NO2至N2,在上述条件下放出的热量为173.4 kJ | |
| D. | 若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移电子3.2 mol |
13.1919年朗缪尔提出等电子体假说:凡原子数,总电子数均相等的物质,其结构相同,性质相似,相应的物质称为等电子体,如CO和N2,下列物质可称为等电子体是( )
| A. | H2O和N2O | B. | CS2和SiO2 | C. | CH4和NH3 | D. | CO2和N2O |
14.如图所示,将铁棒和石墨棒插入1L 1mol•L-1食盐水中.下列说法正确的是( )
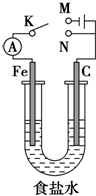

| A. | 若电键K与N连接,铁被保护不会腐蚀 | |
| B. | 若电键K与N连接,正极反应式是4OH--4e-═2H2O+O2↑ | |
| C. | 若电键K与M连接,将石墨棒换成铜棒,可实现铁棒上镀铜 | |
| D. | 若电键K与M连接,当C电极共产生11.2L(标准状况)气体时,生成了1 mol NaOH |
 根据图中A、B两种固体物质的溶解度曲线,回答下列问题:
根据图中A、B两种固体物质的溶解度曲线,回答下列问题: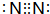 ,物质甲分子的结构式
,物质甲分子的结构式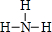 .
. .
.
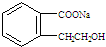 .
.
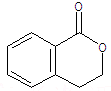 .②由F生成的G化学方程式
.②由F生成的G化学方程式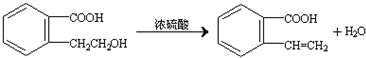 .
. .
.