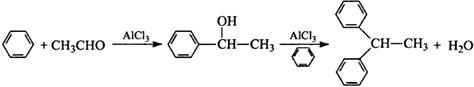
��Ŀ����
����Ŀ��ijͬѧΪ��̽���������ܽ�ƽ��ԭ�����ⶨij�¶���PbI2���ܶȻ����������������ʵ�飺
��ȡ100mL����ˮ�����������PbI2���壨��ɫ�������衢���ã����˵��ྻ���ձ��У��õ���Һa
��ȡ������Һa���Թ��У������м��뼸��0.1mol/L��KI��Һ���۲�����
����ȷ��ȡ10.00mL��Һ�������ӽ�����֬��RH��������Ӧ��2RH+Pb2+=R2Pb+2H+ �� ������ɺ�����Һ���к͵ζ������n��H+��=3.000��10��5mol�������̣�����˵��������ǣ� ��
A.����I�н����Ŀ����ʹ�⻯Ǧ����ܽ�
B.����II�й۲쵽�������Dz�����ɫ����
C.��ʵ���¶��£�PbI2���ܶȻ�����Ksp=1.350��10��8
D.������I ʢװ��Һ���ձ�����������ˮ��Ksp�IJⶨ�������Ӱ��
���𰸡�D
���������⣺A�������ܽ�ʱҪ�ò�������������ܽ⣬���Խ����Ŀ����ʹ�⻯Ǧ����ܽ⣬��A��ȷ��
B���⻯Ǧ������Һ�д��ڳ����ܽ�ƽ�⣬����Һ�еμӼ���0.1molL��1 KI��Һ���������Ũ���������ܽ�ƽ�����ƣ���Һ��c��Pb2+����С����Һ�л��������������Թ۲쵽������Ϊ��������ɫ�������ɫ���ǣ���B��ȷ��
C��ȷ��ȡ10.00mL��Һ�������ӽ�����֬��RH��������Ӧ��2RH+Pb2+=R2Pb+2H+ �� ������ɺ�������Һ���к͵ζ������n��H+��=3.000��10��5mol����n��Pb2+��=1.500��10��5mol������c��Pb2+��= ![]() =1.500��10��3mol/L������c��I����=2c��Pb2+��=3.000��10��3mol/L������Ksp��PbI2��=c��Pb2+����c2��I����=1.350��10��8 �� ��C��ȷ��
=1.500��10��3mol/L������c��I����=2c��Pb2+��=3.000��10��3mol/L������Ksp��PbI2��=c��Pb2+����c2��I����=1.350��10��8 �� ��C��ȷ��
D���������ʢװ��Һ���ձ���������ˮ������Һ��Ũ�ȼ�С����ȡ10.00mL��Һ������Һ�е����Ӻ�Ǧ���ӵ����ʵ���ƫС�����������KspƫС����D����
��ѡD��
A�������ܽ�ʱҪ�ò�������������ܽ⣻
B�����ݵ⻯Ǧ�����ܽ�ƽ���ƶ�������
C������Ksp��PbI2��=c��Pb2+����c2��I������������ӵ�Ũ�ȼ��㣻
D���������ʢװ��Һ���ձ���������ˮ������Һ��Ũ�ȼ�С�������KspƫС��

����Ŀ����25��ʱ���ܱ�������X��Y��Z��������ij�ʼŨ�Ⱥ�ƽ��Ũ�����±���
���� | X | Y | Z |
��ʼŨ��/molL��1 | 0.1 | 0.2 | 0 |
ƽ��Ũ��/molL��1 | 0.05 | 0.05 | 0.1 |
����˵��������ǣ� ��
A.��Ӧ�ﵽƽ��ʱ��X��ת����Ϊ50%
B.��Ӧ�ɱ�ʾΪX+3Y2Z����ƽ�ⳣ��Ϊ1600
C.����ѹǿʹƽ��������Z�ķ����ƶ���ƽ�ⳣ������
D.�ı��¶ȿ��Ըı�˷�Ӧ��ƽ�ⳣ��