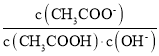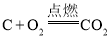题目内容
【题目】某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。
(1)利用如图装置可验证同主族元素非金属性的变化规律:装置D的作用为_____。
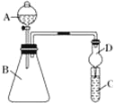
(2)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加_____(填KMnO4或MnO2),写出B中反应的离子方程式_____,C中加淀粉碘化钾混合溶液,观察到C中溶液____的现象,即可证明;
(3)若要证明非金属性:C>Si,则在A中加_____、B中加_____、C中加Na2SiO3溶液,观察到C中溶液出现白色沉淀的现象,即可证明。写出C中发生反应的离子方程式____,此装置有不足之处,应在两个装置中间添加有_____溶液的洗气瓶。
【答案】防倒吸 KMnO4 16H++10Cl-+2MnO4-=2Mn2++8H2O+5Cl2↑ 颜色变蓝色 盐酸 碳酸钙 SiO32-+CO2+H2O= H2SiO3↓+CO32- 饱和碳酸氢钠
【解析】
题给装置是一个可在常温下反应生成气体的气体制备验证装置,球形干燥管所起的作用是防倒吸。
由题给信息,可知此处判断元素的非金属性强弱依据的是:
(1)非金属性越强,元素所对应的单质的氧化性就越强,
(2)非金属性越强,则该元素的最高价氧化物对应的水化物的酸性就越强。
据此进行分析。
(1)仪器D为球形干燥管,可以防止倒吸。故答案为:防倒吸;
(2)要证明非金属性:Cl>I,左边装置应为制备Cl2的装置,根据反应条件,常温下进行,则应选择KMnO4,因为浓盐酸和MnO2反应制Cl2需加热;B中发生反应:16HCl+2KMnO4=2KCl+2MnCl2+8H2O+5Cl2↑,则离子反应方程式为:16H++10Cl-+2MnO4-=2Mn2++8H2O+5Cl2↑;Cl2通入C中,可以将KI中的I-氧化成I2,而淀粉遇I2变蓝,溶液颜色变化为蓝色,可证明非金属性Cl>I,故答案为:KMnO4;16H++10Cl-+2MnO4-=2Mn2++8H2O+5Cl2↑;颜色变蓝色;
(3)元素的非金属性越强,其最高价氧化物对应的水化物的酸性就越强,根据强酸能和弱酸盐反应制成弱酸,故可以在A中加盐酸,B中放碳酸钙,盐酸和碳酸钙反应生成二氧化碳和水,根据题意,C中放硅酸钠,反应后有白色沉淀产生,发生了反应:Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3,离子方程式为:SiO32-+CO2+H2O= H2SiO3↓+CO32-;因为反应中可能会因为盐酸的挥发性导致生成的CO2中混有HCl,盐酸也能和硅酸钠反应生成H2SiO3↓,对实验产生干扰,故可采用饱和碳酸氢钠溶液除去HCl,答案为:盐酸;碳酸钙;SiO32-+CO2+H2O= H2SiO3↓+CO32-;饱和碳酸氢钠。

 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案