题目内容
【题目】(14分)绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途.某化学兴趣小组对绿矾的一些性质进行探究.回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化.再向试管中通入空气,溶液逐渐变红.由此可知:、 .
(2)为测定绿矾中结晶水含量,将石英玻璃管(带端开关K1和K2)(设为装置A)称重,记为m1 g.将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g.按下图连接好装置进行实验.
①仪器B的名称是 .
②将下列实验操作步骤正确排序(填标号);重复上述操作步骤,直至A恒重,记为m3 g.
a.点燃酒精灯,加热b.熄灭酒精灯c.关闭K1和K2
d.打开K1和K2 , 缓缓通入N2e.称量Af.冷却至室温
③根据实验记录,计算绿矾化学式中结晶水数目x=(列式表示).若实验时按a、d次序操作,则使x(填“偏大”“偏小”或“无影响”).
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2 , 缓缓通入N2 , 加热.实验后反应管中残留固体为红色粉末.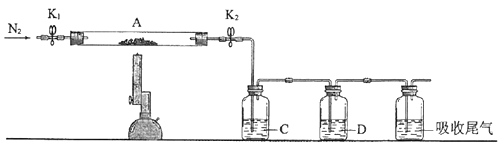
①C、D中的溶液依次为(填标号).C、D中有气泡冒出,并可观察到的现象分别为 .
a.品红b.NaOHc.BaCl2d.Ba(NO3)2e.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式 .
【答案】
(1)硫酸亚铁与KSCN不反应;硫酸亚铁易被空气氧化为硫酸铁
(2)干燥管;dabcfe;![]() ;偏小
;偏小
(3)c、a;产生白色沉淀、品红褪色;2FeSO4 ![]() Fe2O3+SO2↑+SO3↑
Fe2O3+SO2↑+SO3↑
【解析】解:(1)滴加KSCN溶液,溶液颜色无明显变化,可知硫酸亚铁与KSCN不反应,但亚铁离子不稳定,易被空气中氧气氧化生成铁离子,最终溶液变红色,
所以答案是:硫酸亚铁与KSCN不反应;硫酸亚铁易被空气氧化为硫酸铁;(2)①由仪器的图形可知B为干燥管,所以答案是:干燥管;
②实验时,为避免亚铁离子被氧化,应先通入氮气,冷却时注意关闭开关,防止氧气进入,冷却至室温再称量固体质量的变化,则正确的顺序为dabcfe,
所以答案是:dabcfe;
③直至A恒重,记为m3 g,应为FeSO4和装置的质量,则m(FeSO4)=(m3﹣m1),m(H2O)=(m2﹣m3),则n(H2O)= ![]() 、n(FeSO4)=
、n(FeSO4)= ![]() ,结晶水的数目等于
,结晶水的数目等于 ![]() =
= ![]() ,
,
若实验时按a、d次序操作,会导致硫酸亚铁被氧化,则导致固体质量偏大,测定结果偏小,
所以答案是: ![]() ;偏小;(3)①实验后反应管中残留固体为红色粉末,说明生成Fe2O3 , 则反应中Fe元素化合价升高,S元素化合价应降低,则一定生成SO2 , 可知硫酸亚铁高温分解可生成Fe2O3、SO3、SO2 , C为氯化钡,用于检验SO3 , 可观察到产生白色沉淀,D为品红,可用于检验SO2 , 品红褪色,
;偏小;(3)①实验后反应管中残留固体为红色粉末,说明生成Fe2O3 , 则反应中Fe元素化合价升高,S元素化合价应降低,则一定生成SO2 , 可知硫酸亚铁高温分解可生成Fe2O3、SO3、SO2 , C为氯化钡,用于检验SO3 , 可观察到产生白色沉淀,D为品红,可用于检验SO2 , 品红褪色,
所以答案是:c、a;产生白色沉淀、品红褪色;
②硫酸亚铁高温分解可生成Fe2O3、SO3、SO2 , 方程式为2FeSO4 ![]() Fe2O3+SO2↑+SO3↑,所以答案是:2FeSO4
Fe2O3+SO2↑+SO3↑,所以答案是:2FeSO4 ![]() Fe2O3+SO2↑+SO3↑.
Fe2O3+SO2↑+SO3↑.
【考点精析】解答此题的关键在于理解二价Fe离子和三价Fe离子的检验的相关知识,掌握Fe3+遇苯酚溶液呈紫色;可用于检验Fe3+,以及对化学实验操作的先后顺序的理解,了解化学实验顺序遵循:“从下往上”原则;“从左到右”原则;先“塞”后“定”原则;“固体先放”原则;“液体后加”原则;先验气密性(装入药品前进行)原则;后点酒精灯(所有装置完毕后再点酒精灯)原则.