题目内容
【题目】SCR和NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放.
(1)SCR(选择性催化还原)工作原理:
①尿素[CO(NH2)2]水溶液热分解为NH3和CO2 , 该反应的化学方程式: .
②反应器中NH3还原NO2的化学方程式: .
③当燃油中含硫量较高时,尾气中SO2在O2作用下会形成(NH4)2SO4 , 使催化剂中毒.用化学方程式表示(NH4)2SO4的形成: .
④尿素溶液浓度影响NO2的转化,测定溶液中尿素(M=60gmol﹣1)含量的方法如下:取a g尿素溶液,将所含氮完全转化为NH3 , 所得NH3用过量的v1 mL c1 molL﹣1H2SO4溶液吸收完全,剩余H2SO4用v2mL c2 molL﹣1NaOH溶液恰好中和,则尿素溶液中溶质的质量分数是 .
(2)NSR(NOx储存还原)工作原理:
NOx的储存和还原在不同时段交替进行,如图a所示.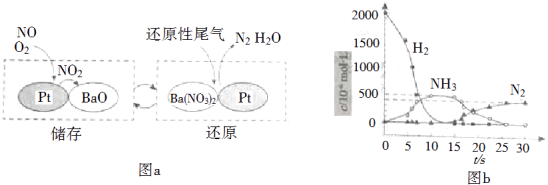
①通过BaO和Ba(NO3)2的相互转化实验NOx的储存和还原.储存NOx的物质是 .
②用H2模拟尾气中还原性气体研究了Ba(NO3)2的催化还原过程,该过程分两步进行,图b表示该过程相关物质浓度随时间的变化关系.第一步反应消耗的H2与Ba(NO3)2的物质的量之比是 .
③还原过程中,有时会产生笑气(N2O).用同位素示踪法研究发现笑气的产生与NO有关.在有氧条件下15NO与NH3以一定比例反应时,得到的笑气几乎都是15NNO.将该反应的化学方程式补充完整: .
【答案】
(1)CO(NH2)2+H2O ![]() 2NH3↑+CO2↑;8NH3+6NO2
2NH3↑+CO2↑;8NH3+6NO2 ![]() 7N2+12H2O;2SO2+O2+4NH3+2H2O═2(NH4)2SO4;
7N2+12H2O;2SO2+O2+4NH3+2H2O═2(NH4)2SO4;![]()
(2)BaO;8:1;415NO+4NH3+3O2 ![]() 415NNO+6H2O
415NNO+6H2O
【解析】解:(1)①尿素[CO(NH2)2]水溶液热分解为NH3和CO2 , 反应物为尿素和水,反应生成物为氨气和水,原子守恒书写化学方程式为:CO(NH2)2+H2O ![]() 2NH3↑+CO2↑,
2NH3↑+CO2↑,
故答案为:CO(NH2)2+H2O ![]() 2NH3↑+CO2↑;
2NH3↑+CO2↑;
②NH3在催化剂作用下还原NO2生成氮气和水,反应的化学方程式为8NH3+6NO2 ![]() 7N2+12H2O,
7N2+12H2O,
故答案为:8NH3+6NO2 ![]() 7N2+12H2O;
7N2+12H2O;
③SO2在O2作用下与NH3、H2O反应形成(NH4)2SO4 , 此反应中SO2是还原剂,氧气是氧化剂,反应的化学方程式为2SO2+O2+4NH3+2H2O═2(NH4)2SO4 ,
故答案为:2SO2+O2+4NH3+2H2O═2(NH4)2SO4;
④涉及反应为2NH3+H2SO4=n(NH4)2SO4 , 2NaOH+H2SO4=Na2SO4+H2O,反应中n(H2SO4)=v1×c1×10﹣3mol,n(NaOH)=v2×c2×10﹣3mol,
由方程式可知n(NaOH)+n(NH3)=2n(H2SO4),
则n(NH3)=(2v1×c1×10﹣3﹣v2×c2×10﹣3)mol,
则m(CO(NH2)2)= ![]() ×(2v1×c1×10﹣3﹣v2×c2×10﹣3)mol×60g/mol=(0.06v1c1﹣0.03v2c2 )g,尿素溶液中溶质的质量分数是
×(2v1×c1×10﹣3﹣v2×c2×10﹣3)mol×60g/mol=(0.06v1c1﹣0.03v2c2 )g,尿素溶液中溶质的质量分数是 ![]() =
= ![]() ,
,
故答案为: ![]() ;(2)①由图示可知BaO和NOx反应生成Ba(NO3)2 , Ba(NO3)2再还原为N2 , 则储存NOx的物质为BaO,故答案为:BaO;
;(2)①由图示可知BaO和NOx反应生成Ba(NO3)2 , Ba(NO3)2再还原为N2 , 则储存NOx的物质为BaO,故答案为:BaO;
②第一步反应中H2被氧化生成水,化合价由0价升高到+1价,Ba(NO3)2的N元素化合价由+5价降低到﹣3价,生成氨气,则1molBa(NO3)2生成氨气转移16mol电子,参加反应的氢气的物质的量为 ![]() =8mol,则消耗的H2与Ba(NO3)2的物质的量之比是8:1,
=8mol,则消耗的H2与Ba(NO3)2的物质的量之比是8:1,
故答案为:8:1;③在有氧条件下15NO与NH3以一定比例反应时,得到的笑气几乎都是15NNO,由N元素守恒可知15NO与NH3应为1:1,可知反应的化学方程式为415NO+4NH3+3O2 ![]() 415NNO+6H2O,
415NNO+6H2O,
故答案为:415NO+4NH3+3O2 ![]() 415NNO+6H2O
415NNO+6H2O
(1)①尿素[CO(NH2)2]水溶液热分解为NH3和CO2 , 结合原子守恒配平书写化学方程式;
②反应器中NH3还原NO2生成氮气和水,根据电子守恒和原子守恒可得此反应的化学方程式;
③SO2在O2作用下与NH3、H2O反应形成(NH4)2SO4 , 此反应中SO2是还原剂,氧气是氧化剂,结合电子守恒和原子守恒可得此反应的化学方程式;
④涉及反应为2NH3+H2SO4=n(NH4)2SO4 , 2NaOH+H2SO4=Na2SO4+H2O,由方程式可知n(NaOH)+n(NH3)=2n(H2SO4),以此计算;(2)①由图a可知储存NOx的物质是BaO;②第一步反应中H2被氧化生成水,化合价由0价升高到+1价,Ba(NO3)2的N元素化合价由+5价降低到﹣3价,生成氨气,结合得失电子数目相等计算;③在有氧条件下15NO与NH3以一定比例反应时,得到的笑气几乎都是15NNO,由N元素守恒可知15NO与NH3应为1:1,结合电子得失相等配平.

 快捷英语周周练系列答案
快捷英语周周练系列答案