题目内容
50℃时,下列各溶液中,离子的物质的量浓度关系正确的是
| A.pH=4的醋酸中:c(H+)=4.0mol·L-1 |
| B.饱和小苏打溶液中:c(Na+)= c(HCO3-) |
| C.饱和食盐水中:c(Na+)+ c(H+)= c(Cl-)+c(OH-) |
| D.pH=12的纯碱溶液中:c(OH-)=1.0×10-2mol·L-1 |
C
试题分析:
A.计算得c(H+)=10-4mol·L-1,错误;B.NaHCO3=Na++ HCO3- ,由于HCO3-的水解,所以
c(Na+)﹥ c(HCO3-),错误;C.溶液中存在Na+、H+、Cl-、OH-,由电荷守恒即可写出等式,正确;D.审题“50℃时”,水的离子积常数大于10-14,所以计算所得的pH=12的纯碱溶液c(OH-)大于1.0×10-2mol·L-1,错误。

练习册系列答案
相关题目
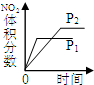
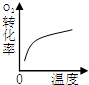
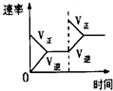
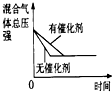
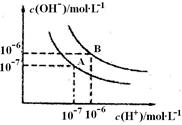

 CO2(g)+H2(g) △H<0。在850℃时,平衡常数K=1。
CO2(g)+H2(g) △H<0。在850℃时,平衡常数K=1。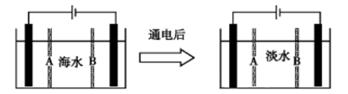
 CH3OH(g)+H2O(g),在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300 ℃):
CH3OH(g)+H2O(g),在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300 ℃):
 2H2O + 。
2H2O + 。