题目内容
一氧化碳是一种用途相当广泛的化工基础原料。
⑴利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍。
Ni(s)+4CO(g) Ni(CO)4(g),该反应的△H______0 (选填“>”或“=”或“<”)。
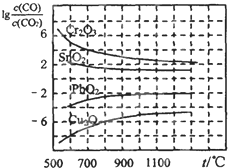
⑵金属氧化物被一氧化碳还原生成金属单质和二氧化碳。下左图是四种金属氧化物(Cr2O3、SnO2、PbO2、Cu2O)被一氧化碳还原时lg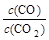 与温度(t)的关系曲线图。则一氧化碳还原三氧化铬反应的化学平衡常数表达式可表示为:K=______________。800℃时,其中最易被还原的金属氧化物是___________,该反应的平衡常数数值(K)等于__________。
与温度(t)的关系曲线图。则一氧化碳还原三氧化铬反应的化学平衡常数表达式可表示为:K=______________。800℃时,其中最易被还原的金属氧化物是___________,该反应的平衡常数数值(K)等于__________。
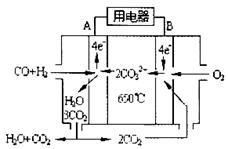
⑶下右图是一碳酸盐燃料电池(MCFC),以水煤气(CO、H2)为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质。依次写出A、B两电极发生反应的电极反应式
__________________________________、___________________________________。
⑷已知:①CO(g)+2H2(g)CH3OH(g) △H=-90.7 kJ·mol-1
②2CH3OH(g)CH3OCH3(g)+H2O(g) △H=-23.5 kJ·mol-1
③CO(g)+H2O(g)CO2(g)+H2(g) △H=-41.2 kJ·mol-1
则3CO(g)+3H2(g)CH3OCH3(g)+CO2(g)的△H=_______________。
20.⑴<
⑵![]() Cu2O 106
Cu2O 106
⑶H2+CO-4e-+2CO32-=H2O+3CO2 2CO2+O2+4e-=2CO32-
⑷-246.1kJ·mol-1 (每空2分,共14分)
解析:略

 阅读快车系列答案
阅读快车系列答案 Ni(CO)4(g) 该反应的△H
Ni(CO)4(g) 该反应的△H
 一氧化碳是一种用途相当广泛的化工基础原料.
一氧化碳是一种用途相当广泛的化工基础原料. Ni(CO)4(g) 该反应的△H
Ni(CO)4(g) 该反应的△H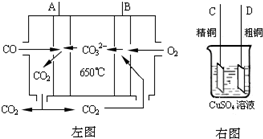

 Ni(CO)4(g),该反应的△H______0 (选填“>”或“=”或“<”)。
Ni(CO)4(g),该反应的△H______0 (选填“>”或“=”或“<”)。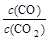 与温度(t)的关系曲线图。则一氧化碳还原三氧化铬反应的化学平衡常数表达式可表示为:K=______________。800℃时,其中最易被还原的金属氧化物是___________,该反应的平衡常数数值(K)等于__________。
与温度(t)的关系曲线图。则一氧化碳还原三氧化铬反应的化学平衡常数表达式可表示为:K=______________。800℃时,其中最易被还原的金属氧化物是___________,该反应的平衡常数数值(K)等于__________。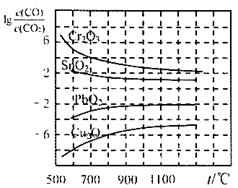
 CH3OH(g) △H=-90.7 kJ·mol-1
CH3OH(g) △H=-90.7 kJ·mol-1