题目内容
一氧化碳是一种用途相当广泛的化工基础原料.
(1)利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍.Ni(s)+4CO(g)
Ni(CO)4(g),该反应的△H 0(选填“>”或“=”或“<”)
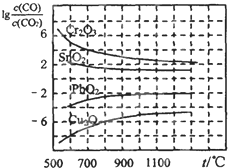
(2)金属氧化物被一氧化碳还原生成金属单质和二氧化碳.如图1是四种金属氧化物(Cr2O3、SnO2、PbO2、Cu2O)被一氧化碳还原时lg
与温度(t)的关系曲线图.则一氧化碳还原三氧化铬反应的化学平衡常数表达式可表示为:K= .800℃时,其中最易被还原的金属氧化物是 ,该反应的平衡常数数值(K)等于 .
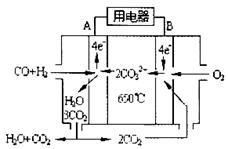
(3)如图2是一碳酸盐燃料电池(MCFC),以水煤气(CO、H2)为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质.写出B极发生的电极反应式 .

(1)利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍.Ni(s)+4CO(g)
| ||
| 180-200℃ |
(2)金属氧化物被一氧化碳还原生成金属单质和二氧化碳.如图1是四种金属氧化物(Cr2O3、SnO2、PbO2、Cu2O)被一氧化碳还原时lg
| c(CO) |
| c(CO2) |
(3)如图2是一碳酸盐燃料电池(MCFC),以水煤气(CO、H2)为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质.写出B极发生的电极反应式

分析:(1)由反应条件可知,低温有利于向正反应进行,高温有利于向逆反应进行,降低温度平衡向放热反应移动,据此判断;
(2)一氧化碳和三氧化铬生成铬和二氧化碳,根据得失电子守恒得其反应方程式为:Cr2O3+3CO
2Cr+3CO2,该反应中只有二氧化碳和一氧化碳为气体,所以其K=
;化学平衡常数越大说明该反应越容易进行,根据化学平衡常数判断;
(3)B电极上通入氧化剂,放电时,氧化剂得电子发生还原反应.
(2)一氧化碳和三氧化铬生成铬和二氧化碳,根据得失电子守恒得其反应方程式为:Cr2O3+3CO
| ||
| c3(CO2) |
| c3(CO) |
(3)B电极上通入氧化剂,放电时,氧化剂得电子发生还原反应.
解答:解:(1)由反应条件可知,低温有利于向正反应进行,高温有利于向逆反应进行,降低温度平衡向放热反应移动,故该反应正反应为放热反应,即△H<0,
故答案为:<;
(2)一氧化碳还原三氧化铬反应的化学方程式为:3CO(g)+Cr2O3(s)
2Cr(s)+3CO2(g),则K=
;
800℃时,K越大,金属氧化物越易被还原,故Cu2O越易被还原,故lg
=-6,则K=106,
故答案为:
;Cu2O;106;
(3)该原电池中,通入燃料的电极是负极,通入氧化剂的电极为正极,正极上氧气得电子和二氧化碳反应生成碳酸根离子,电极反应式为:2CO2+O2+4e-=2CO32-,
故答案为:2CO2+O2+4e-=2CO32-.
故答案为:<;
(2)一氧化碳还原三氧化铬反应的化学方程式为:3CO(g)+Cr2O3(s)
| ||
| c3(CO2) |
| c3(CO) |
800℃时,K越大,金属氧化物越易被还原,故Cu2O越易被还原,故lg
| 1 |
| K |
故答案为:
| c3(CO2) |
| c3(CO) |
(3)该原电池中,通入燃料的电极是负极,通入氧化剂的电极为正极,正极上氧气得电子和二氧化碳反应生成碳酸根离子,电极反应式为:2CO2+O2+4e-=2CO32-,
故答案为:2CO2+O2+4e-=2CO32-.
点评:本题考查了化学平衡影响因素、化学平衡图象、化学平衡常数等,题目综合性强,难度中等,注意理解(2)中纵坐标与平衡常数的关系.

练习册系列答案
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
 Ni(CO)4(g) 该反应的△H
Ni(CO)4(g) 该反应的△H
 一氧化碳是一种用途相当广泛的化工基础原料.
一氧化碳是一种用途相当广泛的化工基础原料. Ni(CO)4(g) 该反应的△H
Ni(CO)4(g) 该反应的△H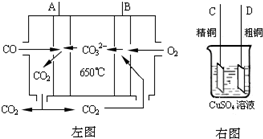
 Ni(CO)4(g),该反应的△H______0 (选填“>”或“=”或“<”)。
Ni(CO)4(g),该反应的△H______0 (选填“>”或“=”或“<”)。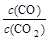 与温度(t)的关系曲线图。则一氧化碳还原三氧化铬反应的化学平衡常数表达式可表示为:K=______________。800℃时,其中最易被还原的金属氧化物是___________,该反应的平衡常数数值(K)等于__________。
与温度(t)的关系曲线图。则一氧化碳还原三氧化铬反应的化学平衡常数表达式可表示为:K=______________。800℃时,其中最易被还原的金属氧化物是___________,该反应的平衡常数数值(K)等于__________。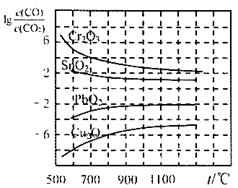
 CH3OH(g) △H=-90.7 kJ·mol-1
CH3OH(g) △H=-90.7 kJ·mol-1