题目内容
【题目】某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验。
实验I 制取氯酸钾和氯水
利用下图所示的实验装置进行实验。
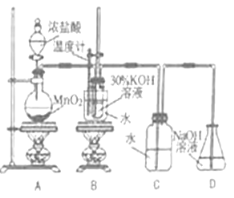
(1)盛放浓盐酸的实验仪器名称是 。
(2)A中发生反应的化学方程式是 。
(3)B中生成氯酸钾的离子反应方程式是 。
(4)若对调B和C装置的位置, (填“能”或“不能”)提高B中氯酸钾的产率,原因是 。
实验II 测定圆底烧瓶中反应残余液中盐酸的浓度
圆底烧瓶中所发生的反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:
甲方案:采用酸碱中和滴定法测定。
乙方案:与足量Zn反应,测量生成的H2体积。
继而进行下列实验:
①进行甲方案实验:准确量取冷却后的残余清液,稀释一定的倍数后作为试样。
a.量取试样20.00ml,用0.10mol·L―1NaOH标准溶液滴定,到达滴定终点时,消耗标准溶液24.00ml,则该次滴定所测的试样中盐酸浓度为 ;
b.重复滴定三次后获得实验结果。
②进行乙方案实验:装置如下图所示(夹持器具已略去)。
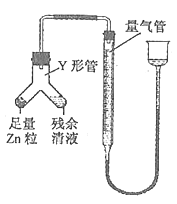
(i)使Y形管中的残余清液与锌粒反应的正确操作是将 转移到 中,否则会造成实验结果偏低。
(ii)反应完毕,读取H2的体积,读数时应注意:A.冷却至室温b. C.视线与凹液面最低处相切。
【答案】实验Ⅰ.(1)分液漏斗;(2)MnO2+4HCl(浓) ![]() MnCl2+ Cl2↑+2H2O;(3)3Cl2+6OH-
MnCl2+ Cl2↑+2H2O;(3)3Cl2+6OH- ![]() ClO3-+5Cl-+3H2O;(4)能;水把Cl2中的HCl除去,减少KOH的损失,可提高KClO3的产率; 实验Ⅱ.①0.12 mol·L—1;②(i)锌粒;残余清液;(ii)调整量气管与漏斗内液面相平。
ClO3-+5Cl-+3H2O;(4)能;水把Cl2中的HCl除去,减少KOH的损失,可提高KClO3的产率; 实验Ⅱ.①0.12 mol·L—1;②(i)锌粒;残余清液;(ii)调整量气管与漏斗内液面相平。
【解析】
试题分析:实验I.(1)盛放盐酸的仪器为分液漏斗;(2)A制备氯气,其反应方程式为:MnO2+4HCl(浓) ![]() MnCl2+ Cl2↑+2H2O;(3)氯气和KOH的反应,其离子反应方程式为:3Cl2+6OH-
MnCl2+ Cl2↑+2H2O;(3)氯气和KOH的反应,其离子反应方程式为:3Cl2+6OH- ![]() ClO3-+5Cl-+3H2O;(4)水把Cl2中的HCl除去,减少KOH的损失,可提高KClO3的产率,故能调换;实验II.①H + + OH- = H2O,n(HCl) = n(NaOH) = 24×10-3×0.1mol,c(HCl) = 24×10-3×0.1/20×10-3mol·L-1 = 0.12mol·L-1;②(i)为使酸全部参加反应,根据装置图,应将锌粒转移到残余清液中;(ii)为了方便换算到标准状况下,需要调整量气管与漏斗内液面相平,使压强相等。
ClO3-+5Cl-+3H2O;(4)水把Cl2中的HCl除去,减少KOH的损失,可提高KClO3的产率,故能调换;实验II.①H + + OH- = H2O,n(HCl) = n(NaOH) = 24×10-3×0.1mol,c(HCl) = 24×10-3×0.1/20×10-3mol·L-1 = 0.12mol·L-1;②(i)为使酸全部参加反应,根据装置图,应将锌粒转移到残余清液中;(ii)为了方便换算到标准状况下,需要调整量气管与漏斗内液面相平,使压强相等。

 阅读快车系列答案
阅读快车系列答案