题目内容
(1)将一定量的Fe粉、Cu粉、FeCl3溶液、CuCl2溶液混合于某容器中充分反应(假定容器不参与反应),判断下列情况下容器中金属离子与金属单质的存在情况:(用符号表示)
①若Fe粉有剩余,则容器中不可能有____________;
②若FeCl3有剩余,则容器中不可能有___________;
③若CuCl2有剩余,则容器中还可能有____________。
(2)有一瓶无色澄清溶液,可能含NH4+、K+、Na +、Mg2+、Ba2+、 Al3+、 Fe3+、SO42-、CO32-、Cl-、I-中的一种或几种,取该溶液进行如下实验:
①用pH试纸检验,表明溶液呈酸性;
②取部分溶液,加入少量CCl4及数滴新制的氯水,经振荡后静置,CCl4层呈紫红色;
③取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐转变为碱性,在滴加过程中及滴加完毕后,溶液中均无沉淀生成;
④取部分上述呈碱性的溶液,加Na2CO3溶液,有白色沉淀生成;
⑤将③得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
根据上述实验事实确定并回答:在溶液中肯定存在的离子有 ,肯定不存在的离子有 ,要确定是否存在的阴离子的实验方法是____________ 。
①若Fe粉有剩余,则容器中不可能有____________;
②若FeCl3有剩余,则容器中不可能有___________;
③若CuCl2有剩余,则容器中还可能有____________。
(2)有一瓶无色澄清溶液,可能含NH4+、K+、Na +、Mg2+、Ba2+、 Al3+、 Fe3+、SO42-、CO32-、Cl-、I-中的一种或几种,取该溶液进行如下实验:
①用pH试纸检验,表明溶液呈酸性;
②取部分溶液,加入少量CCl4及数滴新制的氯水,经振荡后静置,CCl4层呈紫红色;
③取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐转变为碱性,在滴加过程中及滴加完毕后,溶液中均无沉淀生成;
④取部分上述呈碱性的溶液,加Na2CO3溶液,有白色沉淀生成;
⑤将③得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
根据上述实验事实确定并回答:在溶液中肯定存在的离子有 ,肯定不存在的离子有 ,要确定是否存在的阴离子的实验方法是____________ 。
(1)①Fe3+和Cu2+ ②Fe和Cu ③Fe2+、Fe3+ (或Cu Fe2+)
(2)I-、NH4+、Ba2+; SO42-、CO32-、Mg2+、Al3+ 、Fe3+; 取少量溶液于试管中,滴加稀硝酸,再滴加硝酸银溶液,如果有白色沉淀出现,说明含有该阴离子,否则不含有该阴离子。
(2)I-、NH4+、Ba2+; SO42-、CO32-、Mg2+、Al3+ 、Fe3+; 取少量溶液于试管中,滴加稀硝酸,再滴加硝酸银溶液,如果有白色沉淀出现,说明含有该阴离子,否则不含有该阴离子。
试题分析:(1)①由于Fe会发生反应:2Fe3++Fe=3Fe2+;Cu2++Fe=Fe2+ +Cu。因此若Fe粉有剩余,则容器中不可能有Fe3+和Cu2+。②由于FeCl3会发生反应:2Fe3++Fe=3Fe2+;2Fe3++Cu=2Fe2+ +Cu2+.因此若FeCl3有剩余,则容器中不可能有Fe和Cu。③由于CuCl2会发生反应:Cu2++Fe=Fe2+ +Cu若CuCl2有剩余,则容器中不可能有Fe;还可能有Fe2+、Fe3+(或Cu Fe2+)。(2)①用pH试纸检验,表明溶液呈酸性,说明含有大量的H+。由于H+会发生反应:CO32-+2H+=CO2↑+H2O,所以没有CO32-;②取部分溶液,加入少量CCl4及数滴新制的氯水,经振荡后静置,CCl4层呈紫红色;说明发生反应:Cl2+2I-=2Cl-+I2。原溶液中含有I-。由于I-会发生反应:2Fe3++2I-=2 Fe2++I2,故溶液中不含有Fe3+。③取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐转变为碱性,在滴加过程中及滴加完毕后,溶液中均无沉淀生成;证明不含有Mg2+、Al3+。因为若含有它们,则会发生反应:Al3++3OH-=Al(OH)3↓;Mg2++2OH-=Mg(OH)2↓.④取部分上述呈碱性的溶液,加Na2CO3溶液,有白色沉淀生成,证明含有Ba2+,不含SO42-。发生的反应为:Ba2++ CO32-=BaCO3↓。而Ba2+与SO42-因为发生离子反应:SO42-+Ba2+=BaSO4↓而不能大量共存。⑤将③得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。放出的气体为氨气,则原溶液中含有NH4+。反应的方程式为:NH4++ OH-
 NH3↑+H2O。综上所述,在溶液中肯定存在的离子有I-、NH4+、Ba2+;肯定不存在的离子有SO42-、CO32-、Mg2+、Al3+ 、Fe3+;根据溶液呈电中性原理,则溶液中还应该含有阴离子.要确定是否存在的阴离子的实验方法是取少量溶液于试管中,滴加稀硝酸,再滴加硝酸银溶液,如果有白色沉淀出现,说明含有该阴离子,否则不含有该阴离子。
NH3↑+H2O。综上所述,在溶液中肯定存在的离子有I-、NH4+、Ba2+;肯定不存在的离子有SO42-、CO32-、Mg2+、Al3+ 、Fe3+;根据溶液呈电中性原理,则溶液中还应该含有阴离子.要确定是否存在的阴离子的实验方法是取少量溶液于试管中,滴加稀硝酸,再滴加硝酸银溶液,如果有白色沉淀出现,说明含有该阴离子,否则不含有该阴离子。
练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目
 、
、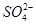 、Cl-、I-、
、Cl-、I-、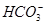 ,取该溶液进行如下实验:
,取该溶液进行如下实验: