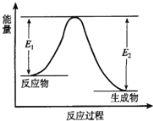
题目内容
【题目】 X、Y、Z、W、R是短周期中的常见元素,其相关信息如下表:
元素 | 相关信息 |
X | 原子核内无中子 |
Y | 组成蛋白质的基础元素,其最高正化合价与最低负化合价的代数和为2 |
Z | 地壳中含量最高的元素 |
W | 原子质量数为23,中子数为12 |
R | 其离子是第三周期金属元素的离子中半径最小的 |
(1)Y、Z、W、R四种元素的原子半径从大到小的顺序是_____________(用元素符号表示)。
(2)Y2电子式为 ;X、Y、Z形成的化合物可用作化肥,该物质所含化学键的类型是 (填共价或离子);X与Z形成的18e-微粒的结构式为 。
(3)砷(As)是人体必需的微量元素,与Y同一主族,As原子比Y原子多两个电子层,则砷的原子序数为________,其最高价氧化物的化学式为____________。该族第二到四周期元素的气态氢化物的稳定性从大到小的顺序是__________________(用化学式表示)。
(4)W在元素周期表中的位置为_______;能够说明W和R金属性强弱的依据有 。
a.W单质的熔点比R单质的熔点低
b.W的化合价比R的低
c.常温下W单质与水的反应很剧烈,而R单质在加热条件下与水反应现象不明显
d.W最高价氧化物的水化物的碱性比R强
(5)写出工业上冶炼R的化学反应方程式 。
【答案】(1) Na>Al>N>O(1分) (2) ![]() (1分) 离子键 共价键(2分)
(1分) 离子键 共价键(2分)
H—O—O—H(1分) (3) 33 As2O5 NH3>PH3>AsH3(各1分)
(4) 第三周期第ⅠA族 cd(各1分) (5)2Al2O3![]() 4Al+3O2↑(2分)
4Al+3O2↑(2分)
【解析】
试题分析:X 原子核内无中子,则X是H;Y是组成蛋白质的基础元素,其最高正化合价与最低负化合价的代数和为2,则Y是N;Z是地壳中含量最高的元素,因此Z是O;W是原子质量数为23,中子数为12,因此W的质子数=23-12=11,所以W是Na;R离子是第三周期金属元素的离子中半径最小的,所以R是Al。
(1)同周期自左向右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,则Y、Z、W、R四种元素的原子半径从大到小的顺序是Na>Al>N>O。
(2)N2电子式为![]() ;X、Y、Z形成的化合物硝酸铵可用作化肥,该物质所含化学键的类型是离子键和共价键;X与Z形成的18e-微粒为双氧水,其结构式为H—O—O—H。
;X、Y、Z形成的化合物硝酸铵可用作化肥,该物质所含化学键的类型是离子键和共价键;X与Z形成的18e-微粒为双氧水,其结构式为H—O—O—H。
(3)砷(As)是人体必需的微量元素,与Y同一主族,As原子比Y原子多两个电子层,则砷的原子序数=2+8+18+5=33,其最高价是+5价,则其氧化物的化学式为As2O5。同主族自上而下非金属性逐渐减弱,氢化物稳定性逐渐减弱,则该族第二到四周期元素的气态氢化物的稳定性从大到小的顺序是NH3>PH3>AsH3。
(4)Na的质子数是11,在元素周期表中的位置为第三周期第ⅠA族;A、金属性强弱与单质的熔沸点没有关系,a错误;b、金属性强弱与化合价没有关系,b错误;c、常温下W单质与水的反应很剧烈,而R单质在加热条件下与水反应现象不明显,这说明金属性是Na强于Al,c正确;d、金属性越强,最高价氧化物水化物的碱性越强在,则W最高价氧化物的水化物的碱性比R强说明钠的金属性强于铝,d正确,答案选cd。
(5)铝是活泼的金属,工业上冶炼R的化学反应方程式为2Al2O3![]() 4Al+3O2↑。
4Al+3O2↑。

 阅读快车系列答案
阅读快车系列答案