题目内容
【题目】无水AlCl3易升华,可用作有机合成的催化剂等。工业上以铝土矿(Al2O3、Fe2O3)为原料制备无水AlCl3的工艺流程如下。
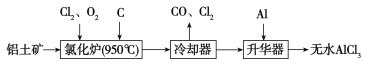
(1)为促进反应的进行,实际生产中需加入焦炭,其原因是
______________________________________________。
(2)用Na2SO3溶液可除去冷却器排出的尾气中的Cl2,此反应的离子方程式为
_______________________________________________。
(3)升华器中主要含有AlCl3和FeCl3,需加入少量Al,其作用是___________________________。
【答案】
(1)加入焦炭消耗反应生成的氧气,使平衡向正反应方向移动
(2)SO+Cl2+H2O===SO+2Cl-+2H+
(3)除去FeCl3
【解析】
试题分析:(1)根据工艺流程可知氯化炉的产物,经冷却、升华可制备无水AlCl3,说明氯化炉中Al2O3转化为A1C13。为了促进该反应的顺利进行,试剂生产中加入焦炭消耗反应生成的氧,即反应方程式为:A12O3+3C12+3C![]() 2A1C13+3CO。
2A1C13+3CO。
故答案为:加入焦炭消耗反应生成的氧气,使平衡向正反应方向移动;
(2)Cl2有强氧化性,将SO32-氧化为SO42-,自身被还原为2C1-。反应离子方程式为:SO32-+C12+H2O═SO42-+2C1-+2H+。
故答案为:SO32-+C12+H2O═SO42-+2C1-+2H+;
(3)升华器中主要含有AlCl3和FeCl3,FeCl3熔点、沸点较低,升华制备无水AlCl3,应除FeCl3去。所以加入少量Al目的是除去FeCl3。
故答案为:除去FeCl3。

 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案【题目】 X、Y、Z、W、R是短周期中的常见元素,其相关信息如下表:
元素 | 相关信息 |
X | 原子核内无中子 |
Y | 组成蛋白质的基础元素,其最高正化合价与最低负化合价的代数和为2 |
Z | 地壳中含量最高的元素 |
W | 原子质量数为23,中子数为12 |
R | 其离子是第三周期金属元素的离子中半径最小的 |
(1)Y、Z、W、R四种元素的原子半径从大到小的顺序是_____________(用元素符号表示)。
(2)Y2电子式为 ;X、Y、Z形成的化合物可用作化肥,该物质所含化学键的类型是 (填共价或离子);X与Z形成的18e-微粒的结构式为 。
(3)砷(As)是人体必需的微量元素,与Y同一主族,As原子比Y原子多两个电子层,则砷的原子序数为________,其最高价氧化物的化学式为____________。该族第二到四周期元素的气态氢化物的稳定性从大到小的顺序是__________________(用化学式表示)。
(4)W在元素周期表中的位置为_______;能够说明W和R金属性强弱的依据有 。
a.W单质的熔点比R单质的熔点低
b.W的化合价比R的低
c.常温下W单质与水的反应很剧烈,而R单质在加热条件下与水反应现象不明显
d.W最高价氧化物的水化物的碱性比R强
(5)写出工业上冶炼R的化学反应方程式 。


