题目内容
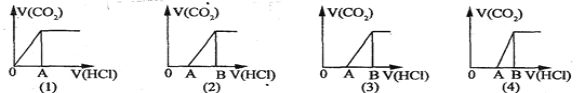
【题目】把由NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量的水中,有1.16g白色沉淀析出,向所得的浊液里,逐渐加入0.5mol/L的盐酸,加入盐酸的体积和生成沉淀的质量如图所示:

(1) 写出m-n段反应的离子方程式 。
(2) 混合物中NaOH的物质的量是____________,AlCl3的物质的量是 ,MgCl2的物质的量是___________。
(3) P点所表示的加入盐酸的体积是_________mL。
【答案】(1) AlO2- + H+ + H2O = Al(OH)3↓
(2) 0.085mol;0.01mol;0.02mol
(3) 170
【解析】
试题分析:(1)向固体组成的混合物溶液中加入盐酸时,0-m时没有沉淀生成,说明溶液中NaOH过量,溶液中铝离子完全转化为偏铝酸根离子,
溶液中存在的沉淀为Mg(OH)2;m-n段,盐酸和偏铝酸钠反应生成氢氧化铝沉淀,离子反应方程式为H2O+AlO2-+H+=Al(OH)3↓;(2)m点沉淀的是氢氧化镁,则n(Mg(OH)2)=![]() =0.02mol,根据Mg原子守恒得n(MgCl2)=n(Mg(OH)2)=0.02mol;m-n段,盐酸和偏铝酸钠反应生成氢氧化铝沉淀,离子反应方程式为H2O+AlO2-+H+=Al(OH)3↓,根据HCl的体积知,n(AlO2-)=n(HCl)=0.5mol/L×(0.03-0.01)L=0.01mol,根据铝原子守恒得n(AlCl3) = n(AlO2-) = 0.01mol;由Na+离子和Cl-离子守恒得,原混合物中n(NaOH) = n(NaCl) = n(Cl-) = 2n(MgCl2)+3n(AlCl3)+n(HCl) = 0.02mol × 2+0.01mol × 3+0.03L × 0.5mol/L = 0.085mol;(3)n-p过程中,氢氧化镁和氢氧化铝都与盐酸反应生成氯化铝和氯化镁,所以C点溶液中的溶质是氯化铝、氯化镁和氯化钠,实际上相当于氢氧化钠和盐酸的反应,所以二者恰好反应时n(NaOH) = n(HCl),则V(HCl) =
=0.02mol,根据Mg原子守恒得n(MgCl2)=n(Mg(OH)2)=0.02mol;m-n段,盐酸和偏铝酸钠反应生成氢氧化铝沉淀,离子反应方程式为H2O+AlO2-+H+=Al(OH)3↓,根据HCl的体积知,n(AlO2-)=n(HCl)=0.5mol/L×(0.03-0.01)L=0.01mol,根据铝原子守恒得n(AlCl3) = n(AlO2-) = 0.01mol;由Na+离子和Cl-离子守恒得,原混合物中n(NaOH) = n(NaCl) = n(Cl-) = 2n(MgCl2)+3n(AlCl3)+n(HCl) = 0.02mol × 2+0.01mol × 3+0.03L × 0.5mol/L = 0.085mol;(3)n-p过程中,氢氧化镁和氢氧化铝都与盐酸反应生成氯化铝和氯化镁,所以C点溶液中的溶质是氯化铝、氯化镁和氯化钠,实际上相当于氢氧化钠和盐酸的反应,所以二者恰好反应时n(NaOH) = n(HCl),则V(HCl) = ![]() = 170mL。
= 170mL。

 口算题天天练系列答案
口算题天天练系列答案【题目】 X、Y、Z、W、R是短周期中的常见元素,其相关信息如下表:
元素 | 相关信息 |
X | 原子核内无中子 |
Y | 组成蛋白质的基础元素,其最高正化合价与最低负化合价的代数和为2 |
Z | 地壳中含量最高的元素 |
W | 原子质量数为23,中子数为12 |
R | 其离子是第三周期金属元素的离子中半径最小的 |
(1)Y、Z、W、R四种元素的原子半径从大到小的顺序是_____________(用元素符号表示)。
(2)Y2电子式为 ;X、Y、Z形成的化合物可用作化肥,该物质所含化学键的类型是 (填共价或离子);X与Z形成的18e-微粒的结构式为 。
(3)砷(As)是人体必需的微量元素,与Y同一主族,As原子比Y原子多两个电子层,则砷的原子序数为________,其最高价氧化物的化学式为____________。该族第二到四周期元素的气态氢化物的稳定性从大到小的顺序是__________________(用化学式表示)。
(4)W在元素周期表中的位置为_______;能够说明W和R金属性强弱的依据有 。
a.W单质的熔点比R单质的熔点低
b.W的化合价比R的低
c.常温下W单质与水的反应很剧烈,而R单质在加热条件下与水反应现象不明显
d.W最高价氧化物的水化物的碱性比R强
(5)写出工业上冶炼R的化学反应方程式 。