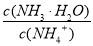题目内容
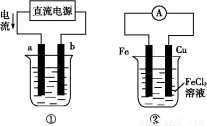
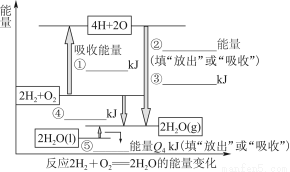
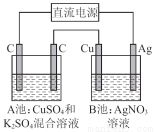
如图所示,通电一段时间后,Cu电极增重2.16 g,同时在A池中收集到标准状况下的气体224 mL,设A池中原混合液的体积为100 mL,则通电前A池中原混合溶液Cu2+的浓度为( )
A.0.05 mol/L B.0.035 mol/L
C.0.025 mol/L D.0.020 mol/L
A
【解析】“Cu电极增重2.16 g”那么Cu作阴极,则A池中左电极是阴极,右电极是阳极;结合,Ag++e-=Ag,电极增重2.16 g(即 =0.02 mol),转移电子0.02 mol。A池中,阳极反应为4OH--4e-=2H2O+O 2↑,转移0.02 mol电子,即得n(O2)=0.005 mol,累计收集气体224 mL(即
=0.02 mol),转移电子0.02 mol。A池中,阳极反应为4OH--4e-=2H2O+O 2↑,转移0.02 mol电子,即得n(O2)=0.005 mol,累计收集气体224 mL(即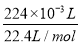 =0.01 mol),那么在阴极还产生0.005 mol H2,阴极反应为2H++2e-=H2↑,转移电子0.01 mol,因此Cu2+放电0.01 mol,Cu2++2e-=Cu,n(Cu2+)=0.005 mol,c(Cu2+)=
=0.01 mol),那么在阴极还产生0.005 mol H2,阴极反应为2H++2e-=H2↑,转移电子0.01 mol,因此Cu2+放电0.01 mol,Cu2++2e-=Cu,n(Cu2+)=0.005 mol,c(Cu2+)= =
= =0.05 mol/L。
=0.05 mol/L。

练习册系列答案
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案
相关题目