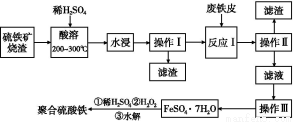
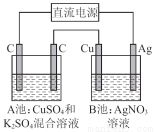
题目内容
关于10 mL 0.1 mol·L-1的NH3·H2O溶液,下列说法正确的是( )
A.25 ℃时,若溶液的pH=11,则Kb(NH3·H2O)=1×10-6 mol·L-1
B.向溶液中加入少量CH3COONa固体,溶液中的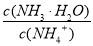 值变小
值变小
C.向溶液中加入10 mL 0.1 mol·L-1 HCl,所得溶液中离子浓度大小顺序为c(NH4+)>c(Cl-)>c(H+)>c(OH-)
D.向溶液中加入5 mL 0.1 mol·L-1 HCl,所得溶液中离子的浓度一定符合:c(NH4+)+c(H+)=c(Cl-)+c(OH-)
D
【解析】A项,氨水中存在平衡NH3·H2O??NH4+ +OH-,若pH=11,则c(NH4+ )=c(OH-)=1.0×10-3 mol·L-1,则Kb(NH3·H2O)=  =mol·L-1=1×10-5 mol·L-1;B项,加入CH3COONa固体抑制氨水的电离,即氨水的电离平衡左移,溶液中的
=mol·L-1=1×10-5 mol·L-1;B项,加入CH3COONa固体抑制氨水的电离,即氨水的电离平衡左移,溶液中的 值变大;溶液中加入10 mL 0.1 mol·L-1 HCl,所得溶液为NH4Cl溶液,由于NH4+ 的水解,c(Cl-)>c(NH4+ ),溶液显酸性,C项错误;根据溶液的电中性,D项正确
值变大;溶液中加入10 mL 0.1 mol·L-1 HCl,所得溶液为NH4Cl溶液,由于NH4+ 的水解,c(Cl-)>c(NH4+ ),溶液显酸性,C项错误;根据溶液的电中性,D项正确

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目