题目内容
关于下列各图的叙述中不正确的是


| A.已知CO的燃烧热为283 kJ/mol,2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ/mol,则图甲表示CO和H2O(g)生成CO2和H2的能量变化 |
| B.某温度下,pH=11的NH3·H2O和pH=1的盐酸等体积混合后(不考虑混合后溶液体积的变化)恰好完全反应,反应后的溶液中NH4+ 、NH3·H2O与NH3三种微粒的平衡浓度之和为0.05 mol·L-1 |
| C.在常温下,X2(g)和H2反应生成HX的平衡常数如表所示,仅依据K的变化,就可以说明在相同条件下,平衡时X2(从F2到I2)的转化率逐渐降低,且X2与H2反应的剧烈程度逐渐减弱 |
D.图乙中曲线表示常温下向弱酸HA的稀溶液中加水稀释过程中, 的变化情况 的变化情况 |
C
A选项,CO燃烧的热化学方程式为
CO(g)+ O2(g)===CO2(g) ΔH1=-283 kJ/mol,
O2(g)===CO2(g) ΔH1=-283 kJ/mol,
H2(g)+ O2(g)===H2O(g) ΔH2=-241.8 kJ/mol,
O2(g)===H2O(g) ΔH2=-241.8 kJ/mol,
用方程式一减去方程式二得CO(g)+H2O(g)===CO2(g)+H2(g),故ΔH=ΔH1-ΔH2=-283 kJ/mol+241.8 kJ/mol=-41.2 kJ/mol;B选项,NH3·H2O是弱碱,盐酸是强酸,pH=1的盐酸溶液中溶质的浓度等于溶液中c(H+)=0.1 mol/L,酸与碱等体积混合恰好反应说明氨水中溶质浓度恰好等于盐酸中溶质浓度,即NH3·H2O溶液中溶质浓度为0.1 mol/L,反应后溶液体积变成原来两倍,由N元素守恒知混合溶液中NH、NH3·H2O与NH3三者浓度和为0.1 mol/L×V L÷2V L=0.05 mol/L;D选项,HA是弱酸,溶液中存在电离方程式:HA H++A-,电离平衡常数
H++A-,电离平衡常数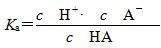 ,温度一定,Ka是个常数,
,温度一定,Ka是个常数,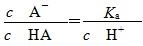 ,稀释过程中c(H+)逐渐减小,故
,稀释过程中c(H+)逐渐减小,故
逐渐增大。
CO(g)+
 O2(g)===CO2(g) ΔH1=-283 kJ/mol,
O2(g)===CO2(g) ΔH1=-283 kJ/mol, H2(g)+
 O2(g)===H2O(g) ΔH2=-241.8 kJ/mol,
O2(g)===H2O(g) ΔH2=-241.8 kJ/mol,用方程式一减去方程式二得CO(g)+H2O(g)===CO2(g)+H2(g),故ΔH=ΔH1-ΔH2=-283 kJ/mol+241.8 kJ/mol=-41.2 kJ/mol;B选项,NH3·H2O是弱碱,盐酸是强酸,pH=1的盐酸溶液中溶质的浓度等于溶液中c(H+)=0.1 mol/L,酸与碱等体积混合恰好反应说明氨水中溶质浓度恰好等于盐酸中溶质浓度,即NH3·H2O溶液中溶质浓度为0.1 mol/L,反应后溶液体积变成原来两倍,由N元素守恒知混合溶液中NH、NH3·H2O与NH3三者浓度和为0.1 mol/L×V L÷2V L=0.05 mol/L;D选项,HA是弱酸,溶液中存在电离方程式:HA
 H++A-,电离平衡常数
H++A-,电离平衡常数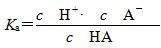 ,温度一定,Ka是个常数,
,温度一定,Ka是个常数,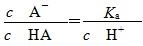 ,稀释过程中c(H+)逐渐减小,故
,稀释过程中c(H+)逐渐减小,故
逐渐增大。

练习册系列答案
相关题目
 Sn(白,s)ΔH3=+2.1 kJ·mol-1
Sn(白,s)ΔH3=+2.1 kJ·mol-1

 。试解释t1—t2,t2—t3速率变化的原因。______________________________________________________。
。试解释t1—t2,t2—t3速率变化的原因。______________________________________________________。




 CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据: