题目内容
已知N2(g)+3H2(g) 2NH3(g) △H=?92.4 kJ·mol-1,在温度相同、容积均为2 L的3个恒容密闭容器中,按不同方式投入反应物,保持恒温,测得反应达到平衡时的有关数据如下,下列说法正确的是
2NH3(g) △H=?92.4 kJ·mol-1,在温度相同、容积均为2 L的3个恒容密闭容器中,按不同方式投入反应物,保持恒温,测得反应达到平衡时的有关数据如下,下列说法正确的是
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1 mol N2、3 mol H2 | 2 mol N2、6 mol H2 | 2 mol NH3 |
| NH3的浓度(mol·L-1) | c1 | c2 | c3 |
| 反应的能量变化 | 放出Q1 kJ | 放出Q2 kJ | 吸收Q3 kJ |
| 体系压强(Pa) | p1 | p2 | p3 |
| 反应物转化率 | α1 | α2 | α3 |
C.2p1=2p3<p2 D.达到平衡时丙容器中NH3的体积分数最大
A
解析试题分析:恒温恒容时,甲和丙为等效平衡。所以:α1+α3=1、Q1+Q3=92.4、Q1=92.4c1(当生成2mol氨气时,放热92.4kJ,此时氨气的浓度为1mol/L)。故A正确;乙中投料是甲的2倍,相当于在甲的基础上增大压强,平衡向右移动,氮气的转化率增大、氨气的体积分数增大、气体的压强减小,所以α2+α3>1 、 2p1=2p3>p2,故B、C、D错误。
考点:考查等效平衡、平衡移动的分析。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案在一定温度条件下,对于已达到平衡的反应:
FeCl3 +3KSCN  3KCl+Fe(SCN)3,在此溶液中作如下处理,平衡左移的是
3KCl+Fe(SCN)3,在此溶液中作如下处理,平衡左移的是
| A.加入少量氯化钾固体 | B.加入少量氯化铁固体 |
| C.减少Fe(SCN)3的浓度 | D.加水稀释 |
当其他条件不变时,下列说法正确的是
| A.使用催化剂一定能加快反应速率 |
| B.用粉末状锌代替块状锌与稀硫酸反应一定会加快反应速率 |
| C.当反应物与生成物浓度相等时,可逆反应一定已达到化学平衡状态 |
| D.在合成氨反应中,增大N2浓度一定可以使H2的转化率达到100% |
一定温度下,在一体积固定的密闭容器中加入2 mol X和1 mol Y,发生如下反应:2X(g)+Y(g) aZ(g)+W(g) ΔH=-Q kJ·mol-1(Q>0,a是正整数)。当反应达到平衡后,放出的热量为Q1 kJ,物质X的转化率为α;平衡后混合气体的平均相对分子质量与温度的关系如图所示,下列说法不正确的是( )
aZ(g)+W(g) ΔH=-Q kJ·mol-1(Q>0,a是正整数)。当反应达到平衡后,放出的热量为Q1 kJ,物质X的转化率为α;平衡后混合气体的平均相对分子质量与温度的关系如图所示,下列说法不正确的是( )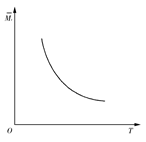
| A.温度升高,平衡常数K减小 |
| B.化学计量数a为1 |
| C.维持温度不变,若起始时向容器中加入a mol Z、1 mol W反应达到平衡后放出的热量为Q2 kJ,则Q1+Q2=Q且Q>Q1>Q2 |
| D.X的转化率α=Q1/Q |
硫酸是一种重要的化工产品,2SO2+O2 2SO3是生产过程中的重要反应。下列对于该反应的说法中正确的是
2SO3是生产过程中的重要反应。下列对于该反应的说法中正确的是
| A.只要选择适宜的条件,SO2和O2就能全部转化为SO3 |
| B.该反应达到平衡后,反应就完全停止了,即正逆反应速率均为零 |
| C.如果反应前充入由18O原子组成的O2,反应达到平衡状态时,18O只存在于O2和SO3中 |
| D.在工业合成SO3时,要同时考虑反应速率和反应能达到的限度两方面的问题 |
一定条件下,在密闭容器中,能表示反应X(g)+2Y(g) 2Z(g)一定达到化学平衡状态的是
2Z(g)一定达到化学平衡状态的是
①X、Y、Z的物质的量之比为1∶2∶2
②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化
④单位时间内生成n mol Z,同时生成2n mol Y
| A.①② | B.①④ | C.②③ | D.③④ |
把铝条放入盛有过量稀盐酸的试管中,不影响氢气产生速率的因素是( )。
| A.盐酸的浓度 | B.铝条的表面积 | C.溶液的温度 | D.加少量Na2SO4 |
下列关于物质“反应程度”的说法正确的是( )
| A.一定条件下,2molsO2与足量O2反应可得到2molsO3 |
| B.含4mol HCl的浓盐酸与足量的MnO2加热反应可制备1mol Cl2 |
| C.10mL 18.0mol/L H2SO4与足量铜加热反应可制备0.09molsO2 |
| D.一定条件下,1mol N2与3mol H2反应可制备1.0mol NH3 |
 4C(g),达到化学平衡时测得c(A)=0.2 mol·L-1;压缩容器使压强增大到2.02×106 Pa,第二次达到平衡时,测得c(A)=0.36 mol·L-1;若继续压缩容器,使压强增大到5.05×106 Pa,第三次达到平衡时,测得c(A)=1.1 mol·L-1。则下列有关说法不正确的是 ( )
4C(g),达到化学平衡时测得c(A)=0.2 mol·L-1;压缩容器使压强增大到2.02×106 Pa,第二次达到平衡时,测得c(A)=0.36 mol·L-1;若继续压缩容器,使压强增大到5.05×106 Pa,第三次达到平衡时,测得c(A)=1.1 mol·L-1。则下列有关说法不正确的是 ( )