题目内容
一定温度下,在一体积固定的密闭容器中加入2 mol X和1 mol Y,发生如下反应:2X(g)+Y(g) aZ(g)+W(g) ΔH=-Q kJ·mol-1(Q>0,a是正整数)。当反应达到平衡后,放出的热量为Q1 kJ,物质X的转化率为α;平衡后混合气体的平均相对分子质量与温度的关系如图所示,下列说法不正确的是( )
aZ(g)+W(g) ΔH=-Q kJ·mol-1(Q>0,a是正整数)。当反应达到平衡后,放出的热量为Q1 kJ,物质X的转化率为α;平衡后混合气体的平均相对分子质量与温度的关系如图所示,下列说法不正确的是( )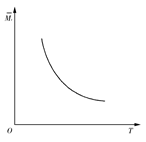
| A.温度升高,平衡常数K减小 |
| B.化学计量数a为1 |
| C.维持温度不变,若起始时向容器中加入a mol Z、1 mol W反应达到平衡后放出的热量为Q2 kJ,则Q1+Q2=Q且Q>Q1>Q2 |
| D.X的转化率α=Q1/Q |
C
解析

练习册系列答案
相关题目
对于①需加热才发生的反应、②放热反应、③熵增加的反应,可能属于自发反应的是
| A.只有② | B.只有③ | C.只有②③ | D.①②③ |
一定条件下,在体积为VL的密闭容器中,一氧化碳和氢气反应生成甲醇: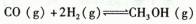
下图表示该反应在不同温度下的反应过程: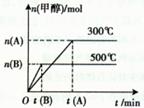
关于该反应,下列说法正确的是:( )
| A.反应达平衡后,升高温度,平衡常数K增大。 |
| B.反应过程中使用Cu2O/ZnO作催化剂,二者均不参加反应。 |
C.500℃反应达到平衡时,用氢气物质的量浓度减少表示该反应的反应速率是: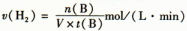 |
| D.300℃反应达到平衡后,若其他条件不变,将体积缩小到原来的1/2,平衡右移,氢气物质的量浓度增大。 |
已知N2(g)+3H2(g) 2NH3(g) △H=?92.4 kJ·mol-1,在温度相同、容积均为2 L的3个恒容密闭容器中,按不同方式投入反应物,保持恒温,测得反应达到平衡时的有关数据如下,下列说法正确的是
2NH3(g) △H=?92.4 kJ·mol-1,在温度相同、容积均为2 L的3个恒容密闭容器中,按不同方式投入反应物,保持恒温,测得反应达到平衡时的有关数据如下,下列说法正确的是
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1 mol N2、3 mol H2 | 2 mol N2、6 mol H2 | 2 mol NH3 |
| NH3的浓度(mol·L-1) | c1 | c2 | c3 |
| 反应的能量变化 | 放出Q1 kJ | 放出Q2 kJ | 吸收Q3 kJ |
| 体系压强(Pa) | p1 | p2 | p3 |
| 反应物转化率 | α1 | α2 | α3 |
C.2p1=2p3<p2 D.达到平衡时丙容器中NH3的体积分数最大
在一定温度下,在恒容的密闭容器中进行的可逆反应A(g)+3B(g) 2C(g)达到平衡的标志是( )
2C(g)达到平衡的标志是( )
| A.C生成的速率和C分解的速率相等 |
| B.单位时间内生成n mol A,同时生成3n mol B |
| C.B的消耗速率与C的消耗速率之比为1∶1 |
| D.混合气体密度保持不变 |
对于反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s) ΔH=-444.3 kJ·mol-1,且熵减小,在常温常压下该反应能自发进行,对反应的方向起决定作用的是( )
| A.焓变 | B.温度 | C.压强 | D.熵变 |
在一定温度下,将等量的气体分别通入起始体积相同的密闭容器Ⅰ(恒容)和Ⅱ(恒压)中,使其发生反应,t0时容器Ⅰ中达到化学平衡,X、Y、Z的物质的量与时间的变化关系如图所示,则下列有关推断正确的是( )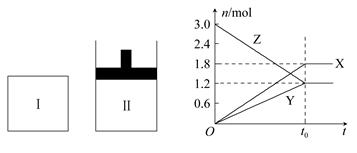
A.该反应的化学方程式:3X+2Y 3Z 3Z |
| B.若两容器中均达到平衡后,两容器的体积V(Ⅰ)<V(Ⅱ),则容器Ⅱ达到平衡所用时间小于t0 |
| C.若两容器中均达到平衡后,两容器中Z的物质的量分数相同,则Y为固态或液态 |
| D.达平衡后,若对容器Ⅱ升高温度时其体积增大,说明Z发生的反应为吸热反应 |
为了进一步研究硫酸铜的量对氢气生成速率的影响,某同学设计了如表一系列实验。将表中所给的试剂按一定体积混合后,分别加入四个盛有过量Zn粒的反应瓶(甲、乙、丙、丁)中,收集产生的气体,记录收集相同体积的气体所需时间。
| 实验 试剂/mL | 甲 | 乙 | 丙 | 丁 |
| 4 mol/L H2SO4 | 20 | V1 | V2 | V3 |
| 饱和CuSO4溶液 | 0 | 2.5 | V4 | 10 |
| H2O | V5 | V6 | 8 | 0 |
下列说法正确的是 ( )
A.实验甲产生气泡的速率最快 B.V1<V2<V3<20
C.V4=V5=10 D.V6=7.5
