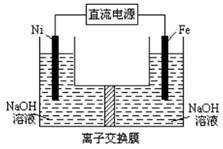
题目内容
用两支惰性电极插入CuSO4溶液中,通电电解,当有1×10-3 mol的OH-放电时,溶液显浅蓝色,则下列叙述正确的是( )
| A.阳极上析出11.2 mL O2(标准状况) | B.阴极上析出32 mg Cu |
| C.阴极上析出11.2 mL H2(标准状况) | D.阳极和阴极质量都无变化 |
B
试题分析:A.当有1×10-3 mol的OH-放电时,则n(e-)=1×10-3 mol.在阳极发生反应:4OH--4e-= O2↑+2H2O。n(O2)= 1×10-3 mol×1/4=2.5×10-4 mol.V(O2)= 2.5×10-4 mol×22.4L/mol=5.6×10-3L=5.6 ml.误。B.在阴极由于放电能力Cu2+>H+。所以电极反应为Cu2++2e-=Cu。在整个闭合回路中电子转移数目相等,所以n(Cu)= 1/2×10-3 mol=5×10-4 mol.m(Cu)=64g/mol×5×10-4 mol=32mg.正确。C.在阴极是Cu离子放电得到Cu单质,不会放出氢气。错误。D.由于在阴极Cu2+放电产生Cu附着在电极上,所以阴极质量会增加;而阳极上是OH-放电产生氧气,所以阳极的质量无变化。错误。

练习册系列答案
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案
相关题目
 2HX(g) (X2表示Cl2、Br2和I2)。
2HX(g) (X2表示Cl2、Br2和I2)。