题目内容
8.下列化学用语中,正确的是( )| A. | 乙炔的结构简式CHCH | B. | 乙醇的比例模型 | ||
| C. | NaCl的电子式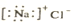 | D. | S原子结构示意图 |
分析 A.炔烃的结构简式中C≡C不能省略;
B.比例模型既能表示分子的空间结构,又能表示出分子中各原子的相对大小,与分子的真实结构最接近;
C.氯化钠是离子化合物,由钠离子与氯离子构成,不存在共价键;
D.硫原子的核电荷数=核外电子总数16,最外层为6个电子.
解答 解:A.炔烃的结构简式中C≡C不能省略,乙炔的结构简式为HC≡CH,故A错误;
B.乙醇分子中含有1个甲基、1个亚甲基和1羟基,则乙醇的比例模型为: ,故B正确;
,故B正确;
C.氯化钠是离子化合物,由钠离子与氯离子构成,不存在共价键,电子式为 ,故C错误;
,故C错误;
D. 为硫离子的结构示意图,硫原子的最外层为6个电子,其正确的原子结构示意图为:
为硫离子的结构示意图,硫原子的最外层为6个电子,其正确的原子结构示意图为: ,故D错误
,故D错误
故选B.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及原子结构示意图与离子结构示意图、比例模型、电子式、结构式等知识,明确常见化学用语的概念及书写原则为解答关键,试题培养了学生的规范答题能力.

练习册系列答案
相关题目
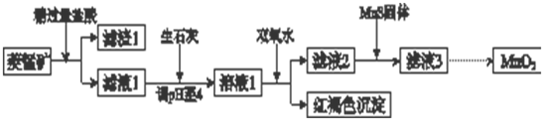
19.工业上用菱锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH)2CO3等杂质]为原料制取二氧化锰,其流程示意图如下:
已知:
生成氢氧化物沉淀的pH
注:金属离子的起始浓度为0.1mol/L
回答下列问题:
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是增大接触面积,提高反应速率.盐酸溶解MnCO3的化学方程式是MnCO3+2HCl=MnCl2+CO2↑+H2O.
(2)向溶液1中加入双氧水时,反应的离子方程式是2Fe2++H2O2+4H2O=2Fe(OH)3↓+4H+.
(3)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,反应的离子方程式是MnS+Cu2+=Mn2++CuS.
(4)将MnCl2转化为MnO2的一种方法是氧化法.其具体做法是用酸化的NaClO3溶液将MnCl2氧化,该反应的离子方程式为:
□Mn2++□ClO3-+□4H2O=□Cl2↑;+□5MnO2+□8H+.
(5)将MnCl2转化为MnO2的另一种方法是电解法.
①生成MnO2的电极反应式是Mn2+-2e-+2H2O=MnO2+4H+.
②若直接电解MnCl2溶液,生成MnO2的同时会产生少量Cl2.检验Cl2的操作是将润湿的淀粉碘化钾试纸置于阳极附近,若试纸变蓝则证明有Cl2生成.
③若在上述MnCl2溶液中加入一定量的Mn(NO3)2粉末,则无Cl2产生.其原因是其它条件不变下,增大Mn2+浓度[或增大c(Mn2+)/c(Cl-)],有利于Mn2+放电(不利于Cl-放电).

已知:
生成氢氧化物沉淀的pH
| Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
| 完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
回答下列问题:
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是增大接触面积,提高反应速率.盐酸溶解MnCO3的化学方程式是MnCO3+2HCl=MnCl2+CO2↑+H2O.
(2)向溶液1中加入双氧水时,反应的离子方程式是2Fe2++H2O2+4H2O=2Fe(OH)3↓+4H+.
(3)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,反应的离子方程式是MnS+Cu2+=Mn2++CuS.
(4)将MnCl2转化为MnO2的一种方法是氧化法.其具体做法是用酸化的NaClO3溶液将MnCl2氧化,该反应的离子方程式为:
□Mn2++□ClO3-+□4H2O=□Cl2↑;+□5MnO2+□8H+.
(5)将MnCl2转化为MnO2的另一种方法是电解法.
①生成MnO2的电极反应式是Mn2+-2e-+2H2O=MnO2+4H+.
②若直接电解MnCl2溶液,生成MnO2的同时会产生少量Cl2.检验Cl2的操作是将润湿的淀粉碘化钾试纸置于阳极附近,若试纸变蓝则证明有Cl2生成.
③若在上述MnCl2溶液中加入一定量的Mn(NO3)2粉末,则无Cl2产生.其原因是其它条件不变下,增大Mn2+浓度[或增大c(Mn2+)/c(Cl-)],有利于Mn2+放电(不利于Cl-放电).
3.如图,烧杯中的溶质均足量,a、b、c、d、e均为石墨电极,通电一段时间后,a电极上有红色物质析出,以下说法正确的是( )
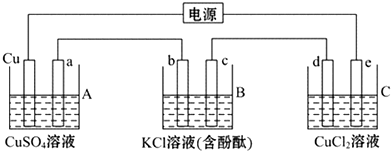

| A. | e电极上可以析出使湿润的淀粉KI试纸变蓝的气体 | |
| B. | c电极周围溶液变红 | |
| C. | A烧杯内溶液的pH升高 | |
| D. | B烧杯中加一定量的KCl固体可恢复原状 |
13.下列褪色现象中,其中一项与其他三项褪色原理不同的是( )
| A. | 二氧化硫能使酸性高锰酸钾溶液褪色 | |
| B. | 氯水能使甲基橙褪色 | |
| C. | 浓硝酸能使石蕊试液褪色 | |
| D. | 臭氧能使品红溶液褪色 |
20.反应2R(g)+5Q(g)═4X(g)+2Y(g)在2L的密闭容器中进行,20s后,R减少了0.04mol,则平均每分钟浓度变化正确的是( )
| A. | R:0.08mol•L-1 | B. | Q:0.05mol•L-1 | C. | X:0.12mol•L-1 | D. | Y:0.06mol•L-1 |
17.下列事实能够说明甲烷分子为正四面体结构,而不是平面正方形结构的是( )
| A. | 甲烷分子中的C-H键完全相同 | |
| B. | 甲烷分子的结构具有对称性 | |
| C. | 甲烷分子的二氯代物只有一种结构 | |
| D. | 分子组成为CHCl3的物质具有固定的熔、沸点 |
18.下列说法正确的是( )
| A. | 石油是混合物,汽油是纯净物 | |
| B. | 分馏汽油和裂解汽油成分相同 | |
| C. | 沸点:汽油>煤油>柴油>润滑油 | |
| D. | 石油的分馏是物理过程,而裂化合裂解是化学过程 |
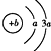 ,Y、Z为同周期金属元素,Y、Z的最高价氧化物对应水化物可以反应生成盐和水.回答下列问题:
,Y、Z为同周期金属元素,Y、Z的最高价氧化物对应水化物可以反应生成盐和水.回答下列问题: