题目内容
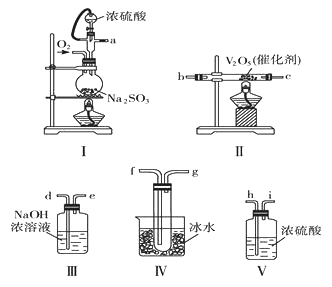
【题目】硼氢化钠(NaBH4)为白色粉末,熔点400℃,容易吸水潮解,可溶于异丙胺(熔点:-101℃,沸点:33℃),在干燥空气中稳定,吸湿而分解,是无机合成和有机合成中常用的选择性还原剂。某研究小组采用偏硼酸钠(NaBO2)为主要原料制备NaBH4,其流程如图:下列说法不正确的是( )
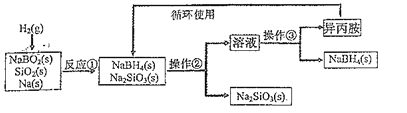
A.NaBH4中H元素显+1价
B.操作③所进行的分离操作是蒸馏
C.反应①为NaBO2+SiO2+4Na+2H2═NaBH4+2Na2SiO3
D.实验室中取用少量钠需要用到的实验用品有镊子、滤纸、玻璃片和小刀
【答案】A
【解析】
A.NaBH4中Na元素显+1价、B元素显+3价、H元素显-1价,A错误;
B.异丙胺沸点为33℃,将滤液采用蒸馏的方法分离,得到异丙胺和固体NaBH4,所以操作③所进行的分离操作是蒸馏,B正确;
C.反应①为NaBO2+SiO2+4Na+2H2═NaBH4+2Na2SiO3,H2作氧化剂,Na作还原剂,C正确;
D.钠硬度小,且保存在煤油里,取用少量钠需要用镊子取出,滤纸吸干煤油,用小刀在玻璃片上切割,D正确;
故答案选A。

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案
相关题目