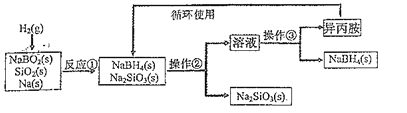
题目内容
【题目】氮氧化物是形成光化学烟雾和酸雨的重要原因。人们研究了诸多有关氮氧化物的性质,请回答下列问题:
(1)处理NOx的一种方法是利用甲烷催化还原NOx。
CH4(g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g) K1
CH4 (g)+2NO2(g) = N2 (g)+CO2(g)+2H2O(g) K2
CH4 (g)+4NO(g) = 2N2 (g)+CO2(g)+2H2O(g) K3
K1、K2、K3依次为三个反应的平衡常数,则K3=____________(用K1、K2表示)
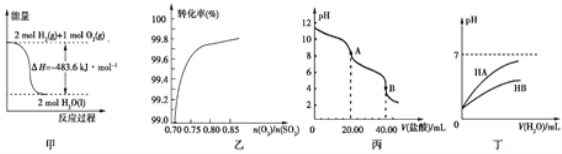
(2)在恒容密闭容器中通入等物质的量的CO和NO,在一定条件下发生反应:2CO(g)+2NO(g)![]() N2(g)+2CO2 (g),测得NO的平衡转化率与温度及压强的关系如图所示:
N2(g)+2CO2 (g),测得NO的平衡转化率与温度及压强的关系如图所示:

①则该反应的△H ________0(填“﹤”“﹥”或“=”)。
②对于气相反应,用某组分(B)的平衡分压强 p(B)代替物质的量浓度 c(B) 也可表示平衡常数kp,如果p1 =1.65MPa,求a点的平衡常数kp =_________(MPa)1 (结果保留 3 位有效数字,分压=总压×物质的量分数)。
(3)利用电化学原理,将NO2、O2和熔融的KNO3制成燃料电池,模拟工业电解法来处理含Cr2O72的废水,如图所示;电解过程中溶液发生反应:Cr2O72+6Fe2++14H+=2Cr3++6Fe3+ +7H2O。

①甲电池工作时,Y是气体,可循环使用。则石墨I附近发生的电极反应式为________。乙池中的pH________(填“变大”“变小”或“不变”)。
②工作时,在相同条件下,甲池内消耗的O2和NO2的体积比为____________。
(4)已知H3PO4为三元酸,Ka1=7.0×103mol·L1,Ka2=6.2×108 mol·L1,Ka3=4.5×1013mol·L 1。则 Na2HPO4水溶液呈________(填“酸”、“中”、“碱”)性,用Ka与Kh的相对大小,说明判断理由_____。
【答案】![]() ﹤ 21.2(MPa)-1 NO2+NO3—-e-=N2O5 变大 1:4 碱 Kh=KW/Ka2=1.6×10-7mol-1>Ka3,HPO42-的水解程度大于电离程度,故而显碱性
﹤ 21.2(MPa)-1 NO2+NO3—-e-=N2O5 变大 1:4 碱 Kh=KW/Ka2=1.6×10-7mol-1>Ka3,HPO42-的水解程度大于电离程度,故而显碱性
【解析】
(1)设CH4(g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g)为①式,CH4 (g)+2NO2(g) = N2 (g)+CO2(g)+2H2O(g)为②式,CH4 (g)+4NO(g) = 2N2 (g)+CO2(g)+2H2O(g)为③式,可知③=②×2-①,故![]() ;
;
(2)①选取任意一条等压线,发现温度越高,NO的平衡转化率越小,即升高温度,平衡逆向移动,故正反应放热,即该反应的△H<0;
②假设反应前投入CO和NO的浓度2amol,可列出

平衡时,CO的物质的量分数为![]() ,NO的物质的量分数为
,NO的物质的量分数为![]() ,氮气的物质的量分数为
,氮气的物质的量分数为![]() ,二氧化碳的物质的量分数为
,二氧化碳的物质的量分数为![]() ,则
,则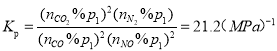 ;
;
(3)Y为N2O5,石墨I为原电池的负极,石墨II为原电池的正极,则Fe(I)为电解池的阳极,Fe(II)为电解池的阴极;
①石墨I附近发生的电极反应式为NO2+NO3—-e-=N2O5,乙池中氢离子放电,导致pH增大;
②因为石墨Ⅰ为负极,原电池中阴离子向负极移动,根据得失电子守恒计算![]() 反应中转移4mol电子,
反应中转移4mol电子,![]() 转变成
转变成![]() ,转移4mol电子,相同状况下气体的体积比等于物质的量之比,故
,转移4mol电子,相同状况下气体的体积比等于物质的量之比,故![]() 和
和![]() 的体积比为1:4;
的体积比为1:4;
(4)Na2HPO4的水解常数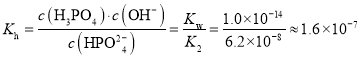 ,HPO42-的电离平衡常数为Ka3=4.5×1013mol·L 1,即HPO42-的水解程度大于其电离程度,因而pH<7。
,HPO42-的电离平衡常数为Ka3=4.5×1013mol·L 1,即HPO42-的水解程度大于其电离程度,因而pH<7。