题目内容
(6分)浓硫酸在下列用途和现象中所表现的性质是
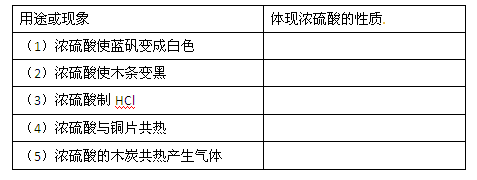
| A.沸点高、难挥发 | B.酸性 | C.吸水性 | D.脱水性 E.强氧化性 |

(6分)C D A B、E E (每个字母1分)
试题分析:(1)浓硫酸具有吸水性,能使蓝矾表白,利用的浓硫酸的吸水性,答案选C。
(2)浓硫酸具有脱水性,能使木条变黑,利用的浓硫酸的脱水性,答案选D。
(3)浓硫酸难挥发性的高沸点的强酸,可以制取氯化氢,利用的浓硫酸的浓硫酸的沸点高、难挥发,答案选A。
(4)浓硫酸具有强氧化性和酸性,在和铜的反应,表现浓硫酸的氧化性和酸性,答案选BE。
(5)浓硫酸在碳加热的反应中,没有硫酸盐生成,只表现出氧化性,答案选E。
点评:该题是基础性试题的考查,试题主要是考查学生对浓硫酸性质的了解掌握程度,以及灵活运用浓硫酸的性质解决实际问题的能力,难度不大,学生记住即可。

练习册系列答案
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案
相关题目