题目内容
14.四只试剂瓶中分别盛装有NaNO3溶液、Na2CO3溶液、Na2SO4溶液和NaCl溶液,在四支试管中分别取四种溶液各1mL,做下列实验.(1)在四支试管中分别滴入硝酸,出现有气泡冒出现象的是Na2CO3溶液,离子方程式是CO32-+2H+=H2O+CO2↑.
(2)在剩余三支试管中分别滴入Ba(NO3)2溶液,出现白色沉淀现象的是Na2SO4溶液,离子方程式是SO42-+Ba2+=BaSO4↓.
(3)在剩余两支试管中分别滴入硝酸银溶液,出现白色沉淀现象的是NaCl溶液,离子方程式是Cl-+Ag+=AgCl↓.三次实验中都没有明显现象的是NaNO3溶液.
分析 碳酸钠溶液与酸反应生成二氧化碳;
硫酸钠溶液与硝酸钡反应生成硫酸钡沉淀;
氯化钠溶液与硝酸银溶液反应生成氯化银沉淀,据此解答.
解答 解:(1)盛装有NaNO3溶液、Na2CO3溶液、Na2SO4溶液和NaCl溶液,分别滴入硝酸,只有碳酸钠溶液与硝酸反应生成二氧化碳,有气泡冒出,离子方程式:CO32-+2H+=H2O+CO2↑;
故答案为:有气泡冒出;Na2CO3溶液;CO32-+2H+=H2O+CO2↑;
(2)在剩余三支试管中分别滴入Ba(NO3)2溶液,只有硫酸钠溶液能发生反应生成硫酸钡白色沉淀,离子方程式:SO42-+Ba2+=BaSO4↓;
故答案为:白色沉淀;Na2SO4溶液;SO42-+Ba2+=BaSO4↓;
(3)在剩余两支试管中分别滴入硝酸银溶液,氯化钠溶液与硝酸银反应生成氯化银白色沉淀,离子方程式:Cl-+Ag+=AgCl↓,硝酸钠溶液不反应,
故答案为:硝酸银溶液;白色沉淀;氯化钠溶液;Cl-+Ag+=AgCl↓;硝酸钠溶液.
点评 本题考查了物质的鉴别,熟悉碳酸盐、硫酸盐、氯化物的性质是解题关键,题目难度不大.

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目
4.下列说法不正确的是( )
| A. | 同温下,0.1 mol•L-1NH4Cl溶液中NH4+的浓度比0.1 mol•L-1氨水中NH4+的浓度大 | |
| B. | 用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl多 | |
| C. | 电解饱和食盐水时,阴极得到氢氧化钠溶液和氢气 | |
| D. | 除去溶液中的Mg2+,用OH-比CO32-效果好,说明Mg(OH)2的溶解度比MgCO3的小 |
5.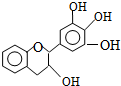 “茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中正确的是( )
“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中正确的是( )
 “茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中正确的是( )
“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中正确的是( )| A. | 分子中所有的原子共面 | |
| B. | 1molEGC与4molNaOH恰好完全反应 | |
| C. | 易发生氧化反应和取代反应,难发生加成反应 | |
| D. | 遇FeCl3溶液发生显色反应且能发生水解反应 |
9.下列溶液中氯离子浓度与20mL 1mol•L-1氯化铝溶液中的氯离子浓度相等的是( )
| A. | 60 mL 1 mol•L-1的氯化钠溶液 | B. | 30 mL 2 mol•L-1的氯化铵溶液 | ||
| C. | 60 mL 3 mol•L-1的氯化钾溶液 | D. | 30 mL 1 mol•L-1的氯化铁溶液 |
19.标准状况下有以下四种气体:①6.72L CH4 ②3.01×1023 个HCl分子 ③13.6g H2S④0.2mol NH3.下列对四种气体的关系从小到大表示不正确的是( )
| A. | 物质的量:④<①<②<③ | B. | 体积:④<①<③<② | ||
| C. | 质量:④<①<③<② | D. | 氢原子个数:②<④<③<① |
3.下列说法正确的是( )
| A. | 冰中每个水分子平均形成两个氢键 | |
| B. | 冰、“可燃冰”、干冰都具有分子密堆积特征 | |
| C. | 分子晶体中一定不存在单个的原子 | |
| D. | “可燃冰”不属于分子晶体 |
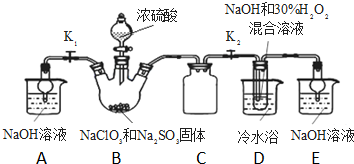 亚氯酸钠(NaClO2)是重要漂白剂.探究小组开展如下实验,回答下列问题:
亚氯酸钠(NaClO2)是重要漂白剂.探究小组开展如下实验,回答下列问题: