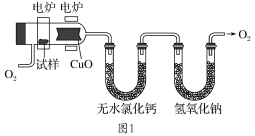
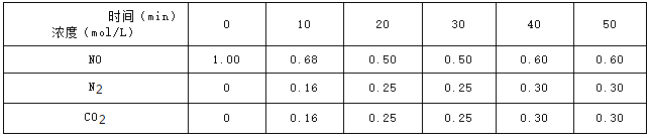
题目内容
【题目】今有常温下两种溶液:① 0.1mol·L-1 NH3·H2O溶液 ② 0.1mol·L-1 NH4Cl溶液。
(1)溶液①的pH_____7(选填 “>”、“<”、“=”),原因是___________________________
(2)溶液②呈_____性(选填 “酸”、“碱”、“中”)原因是____________________________。
(3)关于两种溶液中c(NH4+)的大小叙述正确的是_____(填编号)
a.两种溶液中c(NH4+)都等于0.1mol·L-1
b. 两种溶液中c(NH4+)都小于0.1mol·L-1
c. NH4Cl溶液中c(NH4+)小于NH3·H2O溶液中c(NH4+)
(4)25℃时, 0.1mol/LCH3COOH溶液的pH约为3。向其中加入CH3COONa晶体,待晶体溶解后发现溶液的pH增大。可能的原因有:①_______________;②_______________;为了验证上述哪种解释正确,继续做如下实验:向0.1mol/LCH3COOH溶液中加入少量下列物质中的________(选填字母编号),然后测定溶液的pH。
a.CH3COOK固体 b.CH3COONH4固体 c.NH3 d.NaHCO3固体
(5)25℃时,体积相同,浓度均为0.2mol/L的盐酸和醋酸与镁条反应,开始时两者产生气体的速率盐酸_____(填“大”、“小”或“一样大”),镁条最先消失的是________溶液;如果镁条足量时,选pH相同、等体积的盐酸和醋酸反应,产生气体较多的是________。
【答案】> 氨水是弱碱,电离出氢氧根离子,使得溶液显碱性 酸 氯化铵溶液中铵根离子结合水中氢氧根离子,使得溶液中氢氧根离子浓度小于氢离子浓度,溶液显酸性 b 醋酸钠水解,溶液呈碱性,增大了c(OH-),因而溶液的pH增大 醋酸钠溶于水电离出大量的醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的pH增大 b 大 盐酸 醋酸
【解析】
(1)氨水是弱碱,在水溶液能电离出氢氧根离子,导致氢氧根离子浓度大于氢离子浓度;
(2)氯化铵是强酸弱碱盐,能水解导致溶液中氢离子浓度大于氢氧根离子浓度;盐类水解反应是吸热反应,升高温度能促进水解;
(3)氨水是弱电解质,在水中电离程度很小;氯化铵是强酸弱碱盐,能水解但水解程度很小,主要以电离为主,据此分析铵根离子浓度大小;
(4)0.1mol/LCH3COOH溶液的pH约为3,说明醋酸为弱酸,在醋酸溶液中存在电离平衡CH3COOH ![]() H++CH3COO-。向其中加入CH3COONa晶体,溶液的pH增大,可能是:①醋酸钠水解,溶液呈碱性,②醋酸钠溶于水,电离出大量的醋酸根离子,抑制了醋酸的电离;要验证哪种正确,不能加入碱性物质,只能加入中性物质,据此分析判断;
H++CH3COO-。向其中加入CH3COONa晶体,溶液的pH增大,可能是:①醋酸钠水解,溶液呈碱性,②醋酸钠溶于水,电离出大量的醋酸根离子,抑制了醋酸的电离;要验证哪种正确,不能加入碱性物质,只能加入中性物质,据此分析判断;
(5)相同温度,相同浓度的盐酸和醋酸,盐酸溶液中氢离子浓度大于醋酸溶液中氢离子浓度;pH相同、等体积的盐酸和醋酸,醋酸的物质的量大于盐酸的物质的量,据此分析解答。
(1)氨水是弱碱,在水溶液能电离出氢氧根离子,导致氢氧根离子浓度大于氢离子浓度,溶液呈碱性,溶液的pH>7,电离方程式为:NH3H2ONH4++OH-,故答案为:>;氨水是弱碱,电离出氢氧根离子,使得溶液显碱性,NH3H2ONH4++OH-;
(2)氯化铵是强酸弱碱盐,铵根离子结合水中氢氧根离子发生水解,使得溶液中氢氧根离子浓度小于氢离子浓度,溶液呈酸性,故答案为:酸;氯化铵溶液中铵根离子结合水中氢氧根离子,使得溶液中氢氧根离子浓度小于氢离子浓度,溶液显酸性;
(3)氨水是弱电解质,在水中电离程度很小;氯化铵是强酸弱碱盐,能水解但水解程度很小,主要以电离为主,所以相同浓度的氨水和氯化铵溶液,氯化铵溶液中铵根离子浓度较大,但都小于0.1mol/L,故选b;
(4)0.1mol/LCH3COOH溶液的pH约为3,说明醋酸为弱酸,醋酸溶液中存在电离平衡CH3COOH ![]() H++CH3COO-。向其中加入CH3COONa晶体,待晶体溶解后发现溶液的pH增大,可能的原因有:①醋酸钠水解,溶液呈碱性,增大了c(OH-),因而溶液的pH增大,②醋酸钠溶于水,电离出大量的醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的pH增大;CH3COONH4溶液中,CH3COO-和NH4+都发生水解,且水解程度相等,CH3COONH4溶液呈中性,将CH3COONH4固体加入到0.1 molL-1醋酸中,如pH增大,说明CH3COO-抑制了醋酸的电离,其它物质的水溶液都呈碱性,加入后,溶液的pH一定会增大,不能用于证明,故答案为:醋酸钠水解,溶液呈碱性,增大了c(OH-),因而溶液的pH增大;醋酸钠溶于水,电离出大量的醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的pH增大;b;
H++CH3COO-。向其中加入CH3COONa晶体,待晶体溶解后发现溶液的pH增大,可能的原因有:①醋酸钠水解,溶液呈碱性,增大了c(OH-),因而溶液的pH增大,②醋酸钠溶于水,电离出大量的醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的pH增大;CH3COONH4溶液中,CH3COO-和NH4+都发生水解,且水解程度相等,CH3COONH4溶液呈中性,将CH3COONH4固体加入到0.1 molL-1醋酸中,如pH增大,说明CH3COO-抑制了醋酸的电离,其它物质的水溶液都呈碱性,加入后,溶液的pH一定会增大,不能用于证明,故答案为:醋酸钠水解,溶液呈碱性,增大了c(OH-),因而溶液的pH增大;醋酸钠溶于水,电离出大量的醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的pH增大;b;
(5)相同温度,相同浓度的盐酸和醋酸,盐酸溶液中氢离子浓度大于醋酸溶液中氢离子浓度,所以开始时,盐酸的反应速率大于醋酸的反应速率,反应过程中盐酸的反应速率一直大于醋酸,则镁条最先消失的是盐酸;如果镁条足量时,选pH相同、等体积的盐酸和醋酸,醋酸的物质的量大于盐酸的物质的量,与足量镁条反应,生成氢气较多的是醋酸;故答案为:大;盐酸;醋酸。

【题目】请参照元素①-⑧在表中的位置,根据判断出的元素回答问题:
① | |||||||
② | ③ | ④ | |||||
⑤ | ⑥ | ⑦ | ⑧ |
(1)⑧原子的最外层电子的轨道表达式为___________________,关于它的最外层p亚层电子的说法错误的是_________。(填序号)
a. 能量相同 b.电子云形状相同
c. 自旋方向相同 d. 电子云伸展方向相同
(2)③和①组成的四核分子的化学式为___________,空间构型为_____________,属于_____分子(填“极性”或“非极性”)。
(3)比较④、⑤元素常见离子的半径大小(用化学式表示)______>_____;②、③ 两元素非金属性较强的是 ______(写元素符号),写出证明该结论的一个事实:___________________________ 。
(4)④、⑤元素形成的四原子化合物的电子式为 ___________ ;已知⑥元素的氧化物的熔点为2054℃,且以它为原料,可以通过电解的方法得到铝,据此推断⑥元素的氧化物为_________晶体(填“分子晶体”或“离子晶体”或“原子晶体”或“金属晶体”)。⑥元素的氧化物熔点______⑥元素的氯化物熔点(填“大于”“小于”“等于”),请解释其原因______________________________。
【题目】硼镁泥是一种工业废料,主要成份是MgO(占40%,质量分数),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO47H2O的工艺流程如下:

(1)实验中需要1 mol/L的硫酸800 mL,若用 98% 的浓硫酸(ρ= 1.84 g/mL)来配制,量取浓硫酸需要使用量筒的规格为__________(填写选项字母)
A.10 mL B.20 mL C.50 mL D.100 mL
(2)加入的NaClO可与Mn2+ 反应:Mn2+ + ClO + H2O = MnO2↓+ 2H+ + Cl ,在该步骤中还有一种离子也会被NaClO氧化,该反应的离子方程式为___________________。
(3)滤渣的主要成分除含有Fe(OH)3、Al(OH)3外,还含有__________,___________。
(4)在“除钙”前,需检验滤液中Fe3+ 是否被除尽,简述检验方法___________________。(写出操作、现象和结论)
(5)已知MgSO4、CaSO4 的溶解度(单位为 g/100 g 水)如下表:
温度(℃) | 40 | 50 | 60 | 70 |
MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤______。“操作Ⅰ”是将滤液继续蒸发浓缩,冷却结晶,______,便得到了MgSO47H2O
(6)实验中提供的硼镁泥共100 g,得到 MgSO47H2O为172.2 g ,则MgSO47H2O 的产率为___。