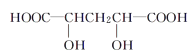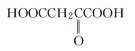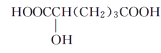题目内容
【题目】反应方程式如下,完成相应问题
___Fe3++___SO2+___H2O→___Fe2++___SO42-+___H+
(1)配平上述反应方程式并标出电子转移的方向和数目__________。
(2)反应中氧化剂为________,还原剂为________。
(3)反应中,所得氧化产物和还原产物的物质的量之比为_____________。
(4)反应过程中,溶液颜色由_______变为_________。
【答案】2 1 2 2 1 4 ![]() Fe3+ SO2 1:2 棕黄色 浅绿色
Fe3+ SO2 1:2 棕黄色 浅绿色
【解析】
根据氧化还原反应的规律及配平原则分析作答。
(1)反应中,Fe元素的化合价由+3降低到+2,S元素的化合价由+4升高到+6,则取最小公倍数为2,所以Fe3+前的系数为2,SO2前的系数为1,结合原子守恒配平,化合价升高值=化合价降低值=转移电子数=2,结合原子守恒配平该方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,1mol SO2参加反应失去2mol电子,用单线桥表示为:![]() ,
,
故答案为:2;1;2;2;1;4;![]() ;
;
(2)反应中,Fe元素的化合价由+3降低到+2,S元素的化合价由+4升高到+6,化合价升高元素被氧化,做还原剂,化合价降低元素被还原,所在的反应物是氧化剂,氧化剂为Fe3+,还原剂为SO2,
故答案为:Fe3+;SO2;
(3)反应中,化合价升高元素对应的产物是氧化产物,化合价降低元素对应的产物是还原产物,所得氧化产物和还原产物分别为SO42- 和Fe2+,它们的物质的量之比为1:2,
故答案为:1:2;
(4)原溶液含有Fe3+,颜色为棕黄色,反应后溶液生成了Fe2+,颜色为浅绿色,故溶液颜色由棕黄色变为浅绿色,
故答案为:棕黄色;浅绿色。

【题目】不同元素的原子在分子内吸引电子的能力大小可用一数值X来表示,若X越大,则原子吸引电子的能力越强,在所形成的分子中成为负电荷一方。下面是某些短周期元素的X值。
元素 | Li | Be | B | C | O | F |
X值 | 0.98 | 1.57 | 2.04 | 2.53 | 3.44 | 3.98 |
元素 | Na | Al | Si | P | S | Cl |
X值 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
(1)通过分析X值的变化规律,确定N、Mg的X值范围:___<X(Mg)<___;___<X(N)<___。
(2)推测X值与原子半径的关系是___。
(3)某有机物结构简式为![]() ,在SN中,你认为共用电子对偏向谁?___(写原子名称)。
,在SN中,你认为共用电子对偏向谁?___(写原子名称)。
(4)经验规律告诉我们当成键的两原子相应元素电负性的差值△X>1.7时,一般为离子键,当△X<1.7时,一般为共价键,试推断AlBr3中化学键的类型是_______。
(5)预测元素周期表中,X值最小的元素位置_______(放射性元素除外)。