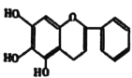
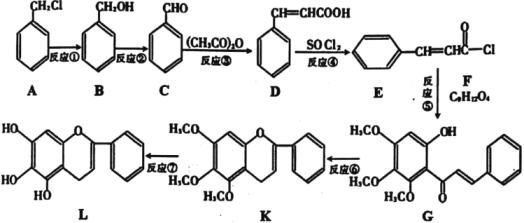
题目内容
【题目】图1是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
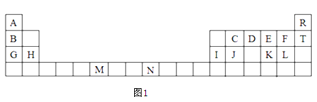
试回答下列问题:
(1)F-的结构示意图:__。
(2)D的气态氢化物的VSEPR模型为___,其中心原子的杂化类型为___,分子的空间构型为___。
(3)G、H和I的第一电离能数值由大到小的顺序为:___(用元素符号作答)。
(4)元素M的化合物(MO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。请回答下列问题:
①与M同周期的所有元素的基态原子中最外层电子数与M原子相同的元素还有____(填元素符号)。
②MO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断MO2Cl2是___(填“极性”或“非极性”)分子。
③在C2H4、CH3Cl、CH2O、CS2、CCl4五种有机化合物中,碳原子采取sp2杂化的分子有___(填分子式)。
(5)已知元素N可形成一种红紫色配合物,其组成为NCl3·5NH3·H2O。该配合物中的中心离子N离子在基态时核外简化电子排布式为___,又已知中心离子N离子的配位数是6,1mol该物质与足量的硝酸银反应可生成3molAgCl,则该物质的配体是___。
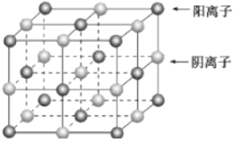
(6)过去常以JE2为催化剂的载体。JE2的晶胞可作如下推导:先将NaCl晶胞中的所有Na+去掉,并将Cl-全部换成J原子,再在每两个不共面的“小立方体”中心处各放置一个J原子便构成了晶体J的一个晶胞,则一个J的晶胞中有___个J原子,再在每两个相邻的J原子(距离最近的两个J原子)中心连线的中点处增添一个E原子,便构成了JE2晶胞,故JE2晶胞中有___个E原子。
【答案】![]() 四面体 sp3杂化 三角锥形 Mg>Al>Na K、Cu 非极性 C2H4、CH2O [Ar]3d6 氨气分子和水分子 8 16
四面体 sp3杂化 三角锥形 Mg>Al>Na K、Cu 非极性 C2H4、CH2O [Ar]3d6 氨气分子和水分子 8 16
【解析】
由元素在周期表中的位置可知,A为H元素,R为He元素,B为Li元素,C为C元素,D为N元素,E为O元素,F为F元素,T为Ne元素,G为Na元素,H为Mg元素,I为Al元素,J为Si元素,K为S元素,L为Cl元素,M为Cr元素,N为Co元素。
(1)F为F元素,![]() 的最外层有10个电子,离子结构示意图为
的最外层有10个电子,离子结构示意图为![]() ,故答案为:
,故答案为:![]() ;
;
(2)D的气态氢化物为氨气,氮原子价层电子对数为![]() ,其中有一对孤电子对,所以VSEPR模型为四面体,空间构型为三角锥形,N原子采取
,其中有一对孤电子对,所以VSEPR模型为四面体,空间构型为三角锥形,N原子采取![]() 杂化,氨分子的空间构型为三角锥形,故答案为:四面体;
杂化,氨分子的空间构型为三角锥形,故答案为:四面体;![]() 杂化;三角锥形;
杂化;三角锥形;
(3)金属活泼性越强,第一电离能越小,但Mg的最外层s电子全满,为稳定结构,则第一电离能最大,所以第一电离能为![]() ,故答案为:
,故答案为:![]() ;
;
(4)①Cr的价电子为![]() ,同周期中K的价电子为
,同周期中K的价电子为![]() ,Cu的价电子为
,Cu的价电子为![]() ,则与Cr同周期的所有元素的基态原子中最外层电子数与Cr原子相同的元素有K、Cu,故答案为:K、Cu;
,则与Cr同周期的所有元素的基态原子中最外层电子数与Cr原子相同的元素有K、Cu,故答案为:K、Cu;
②![]() 、
、![]() 等为非极性分子,非极性分子易溶于非极性分子,
等为非极性分子,非极性分子易溶于非极性分子,![]() 常温下为深红色液体,能与
常温下为深红色液体,能与![]() 、
、![]() 等互溶,则
等互溶,则![]() 是非极性分子,故答案为:非极性;
是非极性分子,故答案为:非极性;
③CH3Cl、![]() 中C原子为
中C原子为![]() 杂化,为四面体结构;而
杂化,为四面体结构;而![]() 、
、![]() 中C原子为
中C原子为![]() 杂化,为平面结构;
杂化,为平面结构;![]() 中C原子为sp杂化,为直线结构,所以碳原子采取
中C原子为sp杂化,为直线结构,所以碳原子采取![]() 杂化的分子有
杂化的分子有![]() 、
、![]() ,故答案为:
,故答案为:![]() 、
、![]() ;
;
(5)N为Co元素,钴离子的化合价是![]() 价,钴离子核外有24个电子,其基态时核外简化电子排布式为
价,钴离子核外有24个电子,其基态时核外简化电子排布式为![]() ,中心离子钴离子的配位数是6,1mol该物质与足量的硝酸银反应可生成3molAgCl,说明该物质中氯元素全部是外界,为氯离子,则氨气分子和水分子为配体,其化学式为
,中心离子钴离子的配位数是6,1mol该物质与足量的硝酸银反应可生成3molAgCl,说明该物质中氯元素全部是外界,为氯离子,则氨气分子和水分子为配体,其化学式为![]() ,故答案为:
,故答案为:![]() ,氨气分子和水分子;
,氨气分子和水分子;
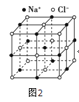
(6)NaCl晶胞如图: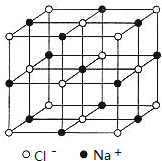 ,将NaCl晶胞中的所有
,将NaCl晶胞中的所有![]() 去掉,并将
去掉,并将![]() 全部换成Si原子,再在每两个不共面的“小立方体”中心处各放置一个Si原子便构成了晶体Si的一个晶胞,则白球可以看成是Si原子,“小立方体”中可放置四个Si原子,故Si晶胞中有
全部换成Si原子,再在每两个不共面的“小立方体”中心处各放置一个Si原子便构成了晶体Si的一个晶胞,则白球可以看成是Si原子,“小立方体”中可放置四个Si原子,故Si晶胞中有![]() 个Si原子,在每两个相邻的Si原子
个Si原子,在每两个相邻的Si原子![]() 距离最近的两个Si原子
距离最近的两个Si原子![]() 中心连线的中点处增添一个O原子,则晶胞中有
中心连线的中点处增添一个O原子,则晶胞中有![]() 个O原子,故答案为:8;16。
个O原子,故答案为:8;16。

 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案【题目】实验室制备1,2-二溴乙烷,可用足量的乙醇先制备乙烯,再用乙烯和少量的溴制备1,2-二溴乙烷,装置如下图所示:
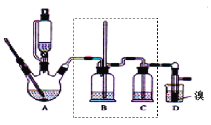
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是____;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置A中除了浓硫酸和乙醇外,还应加入___,其目的是_____,装置A中生成副产物乙醚的化学反应方程式 ______。
(3)实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的二氧化硫,为了验证二氧化硫的存在并除去二氧化硫对后续反应的干扰,某同学在A和D之间加入了B、C两个装置,其中B和C中可分别盛放_____
a.酸性KMnO4和水 b.品红和NaOH溶液
c.酸性KMnO4和NaOH溶液 d.品红和酸性KMnO4
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在____层(填“上”、“下”);若产物中有少量副产物乙醚。可用_____的方法除去。
【题目】减少氮的氧化物和碳的氧化物在大气中的排放是环境保护的重要内容之一。合理应用和处理碳、氮及其化合物,在生产生活中有重要意义。
(1)对温室气体 CO2 的研究一直是科技界关注的重点。在催化剂存在下用 H2 还原 CO2 是解决溫室效应的重要手段之一。
已知:①H2 和 CH4 的燃烧热分别为 285.5 kJ/mol 和 890.0 kJ/mol。
②H2O(1)===H2O(g) ΔH=+44 kJ/mol
试写出H2还原CO2生成CH4和H2O(g)的热化学方程式_____。
(2)CO2在CuZnO催化下,可同时发生如下的反应I、II,其可作为解决温室效应及能源短缺的重要手段。
I.CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)ΔH1=-57.8kJ/mol
CH3OH(g)+H2O(g)ΔH1=-57.8kJ/mol
II.CO2(g)+H2(g)![]() CO(g)+H2O(g)ΔH2=+41.2kJ/mol
CO(g)+H2O(g)ΔH2=+41.2kJ/mol
对于气体参加的反应,表示平衡常数Kp时,用气体组分(B)的平衡分压p(B)代替该气体的平衡浓度c(B),则反应II的Kp=_____[已知:气体各组分的分压p(B),等于总压乘以其体积分数]。
在CuZnO存在的条件下,保持温度T不变,在一刚性密闭容器中,充入一定量的CO2及H2,起始及达平衡时,容器内各气体物质的量如下表:
CO2 | H2 | CH3OH | CO | H2O(g) | 总压/kPa | |
起始/mol | 5.0 | 7.0 | 0 | 0 | 0 | p0 |
平衡/mol | n1 | n2 | p |
若反应I、II均达平衡时,p0=1.2p,则表中n1/span>=_____;若此时n2=3.则反应I的平衡常数Kp=_____(无需带单位,用含总压p的式子表示)。
(3)汽车尾气是雾霾形成的原因之一,研究氮氧化物的处理方法可有效减少雾霾的形成。可采用氧化还原法脱硝:4NO(g)+4NH3(g)+O2(g)![]() 4N2(g)+6H2O(g)ΔH<0
4N2(g)+6H2O(g)ΔH<0
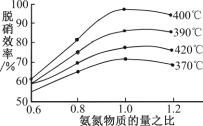
(4)根据图示判断提高脱硝效率的最佳条件是_____;氨氮比一定时,在400℃时,脱硝效率最大,其可能的原因是_____。用活性炭还原法也可以处理氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应:C(s)+2NO(g)![]() N2(g)+CO2(g)ΔH>0在T℃时,反应进行到不同时间测得各物质的量浓度如下:
N2(g)+CO2(g)ΔH>0在T℃时,反应进行到不同时间测得各物质的量浓度如下:
时间/min | 0 | 10 | 20 | 30 | 40 | 50 |
c(NO)/molL1 | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
c(N2)/molL1 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
c(CO2)/molL1 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
30min后,只改变某一条件,根据上表的数据判断改变的条件可能是______填字母)。
A.通入一定量的 CO2 B.加入合适的催化剂 C.适当缩小容器的体积
D.通入一定量的 NO E.加入一定量的活性炭 F.适当升高温度