题目内容
【题目】据报道,我国化学研究人员用Ni(NO3)2和Tb(CH3COO)3等合成了一个镍的一维链状配位聚合物(如图),对镍配合物在磁性、电化学性质等方面的研究提出了理论指导。

请回答下列问题:
(1)基态Ni原子的价电子轨道表达式为____________,Ni在元素周期表中处于第____________纵行。
(2)C、N、O三种元素中电负性最大的是____(填元素符号),C在形成化合物时,其键型以共价键为主,原因是_____________。
(3)Ni(NO3)2中阴离子的空间构型是______,写出与该阴离子互为等电子体的一种分子的化学式:________。
(4)一维链状配位聚合物中,碳原子的杂化形式为________________________。
(5)已知: CH3COOH的沸点为117.9℃, HCOOCH3的沸点为32℃,CH3COOH的沸点高于 HCOOCH3的主要原因是______。
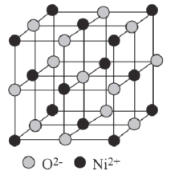
(6)已知:氧化镍的晶胞结构如图所示。
①若NA为阿伏加德罗常数的值,晶体密度为ρg·cm-3,则该晶胞中最近的O2-之间的距离为____pm(用含ρ、NA的代数式表示)。
②某缺陷氧化镍的组成为 Ni0.97O,其中Ni元素只有+2和+3两种价态,两种价态的镍离子数目之比为___。
【答案】![]() 10 O C有4个价电子且半径较小,难以通过得到或失去电子达到稳定结构 平面三角形 SO3(或BF3)(合理即可) sp2、sp3 CH3COOH分子间存在氢键,而HCOOCH3分子之间没有氢键
10 O C有4个价电子且半径较小,难以通过得到或失去电子达到稳定结构 平面三角形 SO3(或BF3)(合理即可) sp2、sp3 CH3COOH分子间存在氢键,而HCOOCH3分子之间没有氢键 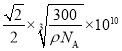 91:6
91:6
【解析】
(1)Ni的原子序数为28,根据构造原理写其价电子轨道表达式;
(2)同周期元素从左至右,电负性依次增强;根据碳原子的原子结构特点分析其成键特点;
(3)根据价层电子对互斥理论分析离子构型;互为等电子体的分子或离子的价电子总数和原子总数均相等;
(4)根据杂化轨道理论分析碳原子的杂化方式;
(5)根据氢键对物质性质的影响分析;
(6)①根据均摊法,确定晶胞中离子个数,进而计算晶胞的质量,再计算晶胞的边长,再根据几何关系计算最近的O2-之间的距离;
②根据守恒思想和化合价代数和为0计算。
(1)Ni的原子序数为28,在元素周期表中处于第10纵行,根据构造原理可写出其价电子轨道表达式为![]() ,故答案为:
,故答案为:![]() ;10;
;10;
(2)同周期元素从左至右,电负性依次增强,则C、N、O三种元素中电负性最大的是O元素,由于C有4个价电子且半径较小,难以通过得到或失去电子达到稳定结构,所以C在形成化合物时,其键型以共价键为主,故答案为:O;C有4个价电子且半径较小,难以通过得到或失去电子达到稳定结构;
(3)Ni(NO3)2的阴离子为NO3-,中心原子N原子的σ键电子对数为3,孤电子对数= ![]() ,则N原子的价层电子对数为3,N原子采取sp2杂化,则其空间构型是平面三角形;SO3(或BF3)与其互为等电子体,它们的价电子总数和原子总数均相等,故答案为:平面三角形;SO3(或BF3)(合理即可);
,则N原子的价层电子对数为3,N原子采取sp2杂化,则其空间构型是平面三角形;SO3(或BF3)与其互为等电子体,它们的价电子总数和原子总数均相等,故答案为:平面三角形;SO3(或BF3)(合理即可);
(4)由一维链状配位聚合物的结构可知,其碳原子的σ键电子对数为分别为3、4,没有孤电子对,则碳原子的价层电子对数分别为3、4,则碳原子的杂化形式为sp2、sp3,故答案为:sp2、sp3;
(5)在CH3COOH中存在O-H键,因此分子之间可形成氢键,而HCOOCH3分子不具备形成氢键的条件,分子之间没有氢键,因此CH3COOH的沸点较高,故答案为:CH3COOH分子间存在氢键,而HCOOCH3分子之间没有氢键;
(6)①根据均摊法可知,晶胞中O2-的个数为![]() ,Ni2+的个数为
,Ni2+的个数为![]() ,则晶胞的质量为
,则晶胞的质量为![]() ,则晶胞的边长为
,则晶胞的边长为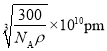 ,则该晶胞中最近的O2-之间的距离为
,则该晶胞中最近的O2-之间的距离为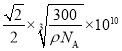 pm,故答案为:
pm,故答案为: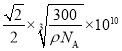 ;
;
②设Ni2+和Ni3+的个数分别为x、y,则可得方程组,x+y=0.97,2x+3y=2,x=0.91,y=0.06,则Ni2+和Ni3+的个数之比为0.91:0.06=91:6,故答案为:91:6。

 名校课堂系列答案
名校课堂系列答案