题目内容
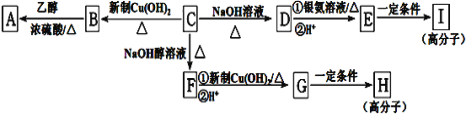
【题目】从铜氨废液含[Cu(NH3)3·CO]+、[Cu(NH3)2]2+、[Cu(NH3)4]2+、NH3、CH3COO-、CO32-等中回收铜的工艺流程如图:

(1)步骤(Ⅰ)“吹脱”的目的是___(写一条即可);由步骤(Ⅱ)可确定NH3与H+的结合能力比与Cu2+的___(填“强”或“弱”)。
(2)步骤(Ⅲ)“沉铜”时,Na2S的用量比理论用量多,目的是___。
(3)步骤(Ⅳ)反应中,氧化产物与还原产物的物质的量之比为___。
(4)步骤(Ⅵ)发生反应生成难溶Cu2(OH)3Cl的离子方程式为___,pH与铜的回收率关系如图(a)所示,为尽可能提高铜的回收率,需控制的pH约为___。
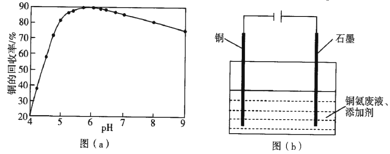
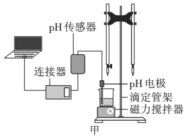
(5)“吹脱”后的铜氨溶液中加入适量的添加剂可直接电解回收金属铜,装置如图(b)所示,阴极主要发生的电极方程式为___;添加NaCl和H2SO4均可提高电导率和电流效率,从而提高铜的回收率,从环境角度考虑,较好的是___(填“NaCl”或“H2SO4”)。
(6)已知上述流程中只有步骤(Ⅲ)“沉铜”和步骤Ⅴ“制硫酸铜”中铜元素有损耗。步骤(Ⅲ)“沉铜”时铜元素的损耗率为4%;步骤Ⅴ“制硫酸铜”时铜元素损耗率为2%。若1L废液最终制得CuSO45H2O375g,则1L废液中含有铜元素的质量为___g。(保留整数)
【答案】将Cu(Ⅰ)氧化为Cu(Ⅱ)、将CO氧化并以CO2吹出、吹出游离的NH3等 强 使Cu2+尽可能沉淀完全,降低残留率 3:2 2[Cu(NH3)4]2++Cl+5H++3H2O=Cu2(OH)3Cl↓+8NH4+ 6(或5.56.5) [Cu(NH3)4]2++2e=Cu+4NH3 H2SO4 102
【解析】
从铜氨废液含[Cu(NH3)3·CO]+、[Cu(NH3)2]2+、[Cu(NH3)4]2+、NH3、CH3COO-、CO32-等中回收铜,废液中通入热空气,并加热,可生成二氧化碳、氨气,得到含有[Cu(NH3)4]2+、CH3COO-、CO32-的溶液,加入20%的硫酸,调节pH=2,得到硫酸铜、硫酸铵溶液,加入20%的硫化钠溶液生成CuS沉淀,在沉淀中加入硝酸可生成NO、S和硝酸铜,加入硫酸生成硫酸铜,经蒸发晶体得到无水硫酸铜晶体;[Cu(NH3)4]2+、CH3COO-、CO32-的溶液加入盐酸,经过滤、洗涤、干燥,可得到碱式氯化铜,以此解答该题。
(1)步骤(Ⅰ)“吹脱”时通入空气,氧气可将Cu(Ⅰ)氧化为Cu(Ⅱ)、将CO氧化生成CO2吹出、吹出游离的NH3等,步骤(Ⅱ)加入硫酸生成硫酸铵,可确定NH3与H+的结合能力比与Cu2+的强,故答案为:将Cu(Ⅰ)氧化为Cu(Ⅱ)、将CO氧化并以CO2吹出、吹出游离的NH3等;强;
(2)步骤(Ⅲ)“沉铜”时,Na2S的用量比理论用量多,可使Cu2+尽可能生成CuS沉淀,可降低残留率,故答案为:使Cu2+尽可能沉淀完全,降低残留率;
(3)CuS与硝酸反应生成NO、S,反应中S元素化合价由2价升高到0价,N元素化合价由+5价降低为+2价,则氧化产物与还原产物的物质的量之比为3:2,故答案为:3:2;
(4)步骤(Ⅵ)发生反应生成难溶Cu2(OH)3Cl的离子方程式为2[Cu(NH3)4]2++Cl+5H++3H2O=Cu2(OH)3Cl↓+8NH4+,由图可知为尽可能提高铜的回收率,需控制的pH约为6(或5.56.5),故答案为:2[Cu(NH3)4]2++Cl+5H++3H2O=Cu2(OH)3Cl↓+8NH4+;6(或5.56.5);
(5)阴极主要发生反应的电极反应式为[Cu(NH3)4]2++2e=Cu+4NH3,如加入盐酸,则阳极发生氧化反应生成氯气,污染空气,从环保的角度可知,应加入硫酸,故答案为:[Cu(NH3)4]2++2e=Cu+4NH3;H2SO4;
(6)375gCuSO45H2O中Cu的质量=375g×![]() ÷(12%)÷(14%)=102g,故答案为:102。
÷(12%)÷(14%)=102g,故答案为:102。