题目内容
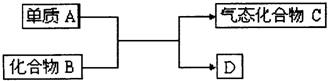
18.下列关于CO2和SiO2性质的说法中,不正确的是( )| A. | SiO2与CaCl2溶液不反应,而CO2通入CaCl2溶液中可得到白色沉淀 | |
| B. | CO2通入到水玻璃中可以得到硅酸 | |
| C. | CO2与SiO2在物理性质上差别很大 | |
| D. | CO2和SiO2都是酸性氧化物,都能与NaOH溶液反应 |
分析 A.盐酸的酸性强于碳酸;
B.碳酸酸性强于硅酸;
C.二者结构不同,晶体类型不同;
D.酸性氧化物都能够与碱反应生成盐和水.
解答 解:A.盐酸的酸性强于碳酸,二氧化碳与氯化钙溶液不反应,故A错误;
B.碳酸酸性强于硅酸,CO2通入到水玻璃中可以得到硅酸,故B正确;
C.二氧化碳为分子晶体,二氧化硅为原子晶体,二者结构不同,所以物理性质不同,故C正确;
D.CO2和SiO2都是酸性氧化物,都能与NaOH溶液反应,故D正确;
故选:A.
点评 本题考查了硅及二氧化硅性质,熟悉强酸制备弱酸规律、熟悉酸性氧化物、二氧化碳、二氧化硅晶体结构是解题关键,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.8月12日,天津港瑞海公司危险化学品仓库发生爆炸事故,爆炸现场存储的桶装氰化钠有少量因爆炸冲击发生泄漏.氰化钠属剧毒物质,用过氧化氢处理氰化钠现场和水污染的方程式为NaCN+H2O2+H2O=NaHCO3+NH3↑.下列说法不正确的是( )
| A. | NaCN中氮元素的化合价为+3 | |
| B. | 用双氧水处理现场前,应紧急疏散群众 | |
| C. | 每生成1molNH3转移2mol电子 | |
| D. | NaCN中既含有离子键又含有共价键的 |
13.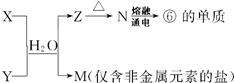 表为元素周期表的一部分,请参照元素①-⑨在表中的位置,回答下列问题:
表为元素周期表的一部分,请参照元素①-⑨在表中的位置,回答下列问题:
(1)由①、②两种元素组成的相对分子质量为28的有机物的结构式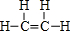 ,该物质与溴水发生加成反应的化学方程式是CH2=CH2+Br2→BrCH2CH2Br.
,该物质与溴水发生加成反应的化学方程式是CH2=CH2+Br2→BrCH2CH2Br.
(2)用电子式表示④的简单氢化物的形成过程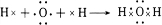
(3)用①元素的单质与④元素的单质可以制成原电池,电池中装有KOH浓溶液,将多孔的惰性电极甲和乙浸入KOH溶液中,在甲极通入①的单质,乙极通入④的单质,则甲极的电极反应式为:H2-2e-+2OH-=2H2O
(4)由表中①、③、④、⑥、⑧元素形成的常见物质X、Y、Z、M、N可发生(如图)反应:
X溶液与Y溶液反应的离子方程式为Al3++3NH3.3H2O=Al(OH)3↓+3NH4+,工业上常用单质⑥冶炼难熔的金属,写出氧化铁和单质⑥在高温下反应的化学方程式2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3.
 表为元素周期表的一部分,请参照元素①-⑨在表中的位置,回答下列问题:
表为元素周期表的一部分,请参照元素①-⑨在表中的位置,回答下列问题: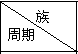 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑨ | ⑥ | ⑦ | ⑧ |
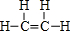 ,该物质与溴水发生加成反应的化学方程式是CH2=CH2+Br2→BrCH2CH2Br.
,该物质与溴水发生加成反应的化学方程式是CH2=CH2+Br2→BrCH2CH2Br.(2)用电子式表示④的简单氢化物的形成过程
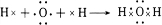
(3)用①元素的单质与④元素的单质可以制成原电池,电池中装有KOH浓溶液,将多孔的惰性电极甲和乙浸入KOH溶液中,在甲极通入①的单质,乙极通入④的单质,则甲极的电极反应式为:H2-2e-+2OH-=2H2O
(4)由表中①、③、④、⑥、⑧元素形成的常见物质X、Y、Z、M、N可发生(如图)反应:
X溶液与Y溶液反应的离子方程式为Al3++3NH3.3H2O=Al(OH)3↓+3NH4+,工业上常用单质⑥冶炼难熔的金属,写出氧化铁和单质⑥在高温下反应的化学方程式2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3.
3.向体积为Va 的0.05mol•L-1CH3COOH溶液中加入体积为Vb的0.05mol•L-1KOH溶液,下列关系错误的是( )
| A. | Va>Vb时:c (CH3COOH)+c (CH3COO-)>c (K+) | |
| B. | Va=Vb时:c(CH3COOH)+c (H+)=c(OH-) | |
| C. | Va<Vb时:c(CH3COO-)>c (K+)>c(OH-)>c(H+) | |
| D. | Va与Vb任意比时:c(K+)+c (H+)=c(OH-)+c(CH3COO-) |
10.下列离子组能大量共存的是( )
| A. | Fe3+ Na+ S2- Cl- | B. | Al3+ NH4+ AlO2- NO3- | ||
| C. | NH4+ Mg2+ SO42- Cl- | D. | H+ Na+ HCO3- SiO32- |
8.下列溶液中溶质的物质的量浓度为1mol/L的是( )
| A. | 将40g NaOH固体溶解于1L水中 | |
| B. | 将22.4L氯化氢气体溶于水配成lL溶液 | |
| C. | 将1L 10mol/L的浓盐酸与9L水混合 | |
| D. | 20g NaOH固体溶解在水中配成500mL溶液 |