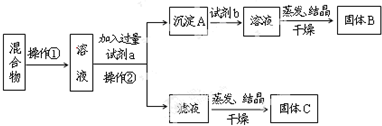
题目内容
8.下列溶液中溶质的物质的量浓度为1mol/L的是( )| A. | 将40g NaOH固体溶解于1L水中 | |
| B. | 将22.4L氯化氢气体溶于水配成lL溶液 | |
| C. | 将1L 10mol/L的浓盐酸与9L水混合 | |
| D. | 20g NaOH固体溶解在水中配成500mL溶液 |
分析 A.体积指溶液体积不是溶剂体积;
B.根据温度、压强对气体摩尔体积的影响分析判断;
C.根据不同液体混合时体积能否直接加和判断;
D.质量换算物质的量,依据浓度概念计算得到.
解答 解:A.体积指溶液体积不是溶剂体积,所以40gNaOH溶解于1L水中配成的NaOH溶液浓度不是1mol/L,故A错误;
B.气体摩尔体积受温度和压强的影响,温度越高,气体摩尔体积越大,标况下,22.4LHCl的物质的量是1mol,常温常压下,22.4LHCl的物质的量小于1mol,所以常温常压下将22.4LHCl气体溶于水配成1L的盐酸溶液的物质的量浓度不是1mol/L,故B错误;
C.1L10mol/L的浓盐酸与9L水混合配成溶液的体积不是10L,所以混合后溶液的物质的量浓度不是1mol/L,故C错误;
D.20gNaOH物质的量为0.5mol,溶解后配制为500ml的溶液,其浓度为1 mol•L-1,故D正确.
故选D.
点评 本题考查学生对物质的量浓度的理解,比较基础,注意B选项中气体摩尔体积的使用条件与对象,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.下列关于CO2和SiO2性质的说法中,不正确的是( )
| A. | SiO2与CaCl2溶液不反应,而CO2通入CaCl2溶液中可得到白色沉淀 | |
| B. | CO2通入到水玻璃中可以得到硅酸 | |
| C. | CO2与SiO2在物理性质上差别很大 | |
| D. | CO2和SiO2都是酸性氧化物,都能与NaOH溶液反应 |
19.下列关于氢键的说法中正确的是( )
| A. | 氢键比分子间作用力强,所以它属于化学键 | |
| B. | 分子内形成的氢键使物质的熔点和沸点升高 | |
| C. | 氨溶于水后氨分子和水分子之间形成了氢键 | |
| D. | 邻羟基苯甲酸的熔点比对羟基苯甲酸的熔点高 |
16.(1)反应N2O4(g)?2NO2(g);△H>0的平衡体系中,在298K时,平衡常数为K1,在273K时,平衡常数为K2,在373K时平衡常数为K3,K1、K2、K3之间的数量大小关系是K3>K1>K2..
(2)在298K时,将0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
20~40s内用N2O4表示的平均反应速率为0.002mol•L-1•s-1;298K时该反应的平衡转化率=75%;反应进行至100s后将反应混合物的温度降低,混合气体的颜色变浅(填“变浅”、“变深”或“不变”);
(3)298K时,反应2NO2(g)?N2O4(g);△H<0达到平衡后,根据下列图象判断引起平衡移动的因素及平衡移动的方向:
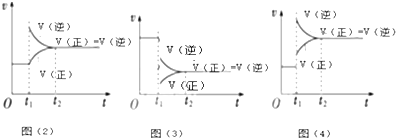
图(2)平衡将向正反应方向移动;图(3)引起平衡移动的因素是减小压强,图(4)引起平衡移动的因素是升高温度.
(2)在298K时,将0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间/s n/mol | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(3)298K时,反应2NO2(g)?N2O4(g);△H<0达到平衡后,根据下列图象判断引起平衡移动的因素及平衡移动的方向:

图(2)平衡将向正反应方向移动;图(3)引起平衡移动的因素是减小压强,图(4)引起平衡移动的因素是升高温度.
13.CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示.下列说法不正确的是( )


| A. | 途径①所用混酸中H2SO4与HNO3物质的量之比最好为3:2 | |
| B. | 相对于途径①、③,途径②更好地体现了绿色化学思想 | |
| C. | 混合气体X不能使品红溶液褪色 | |
| D. | Y可以是葡萄糖 |
17.已知下列2个氧化还原反应:①2Fe3++2I-═2Fe2++I2②Cl2+2FeCl2═2FeCl3,则下列说法中正确的是( )
| A. | 氧化性:Cl2>Fe3+>I2 | B. | 氧化性:Fe3+>I2>Cl2 | ||
| C. | 还原性:I-<Fe2+<Cl- | D. | 还原性:Cl-<I-<Fe2+ |
5.下列有关能量转换的说法正确的是( )
| A. | 风力发电是化学能转换为电能 | |
| B. | 植物燃烧时放出的能量来源于太阳能 | |
| C. | 动物体内的葡萄糖被氧化成CO2,是热能转换成化学能 | |
| D. | 植物通过光合作用将CO2转化为葡萄糖,是将太阳能转换成热能 |
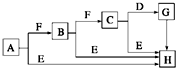 下面是有关物质的转化关系图(部分产物已省略),其中A为单质,E在常温下为液体,D是一种气体,C的相对分子质量为78.请回答下列有关问题:
下面是有关物质的转化关系图(部分产物已省略),其中A为单质,E在常温下为液体,D是一种气体,C的相对分子质量为78.请回答下列有关问题: ;G→H的化学方程式Na2CO3+Ca(OH)2═CaCO3↓+2NaOH.
;G→H的化学方程式Na2CO3+Ca(OH)2═CaCO3↓+2NaOH.