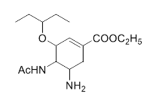
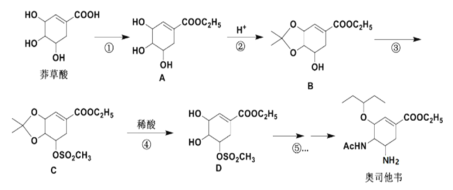
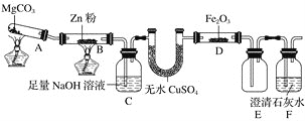
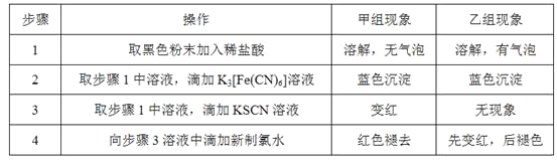
题目内容
【题目】将2.3g钠投入到97.8g水中,反应完毕后,得到100mL的溶液。求:
(1)产生氢气在标况下的体积_____。
(2)所得氢氧化钠溶液的溶质质量分数______。
(3)所得氢氧化钠溶液的物质的量浓度_____。
【答案】1.12L 4% 1mol·L-1
【解析】
Na与水的反应2Na+2H2O=2NaOH+H2↑,反应后溶液的溶质为氢氧化钠,据此计算出氢氧化钠的质量分数:ω= ![]() ×100%,物质的量浓度:c=
×100%,物质的量浓度:c=![]() 。
。
(1)2.3 g Na的物质的量:![]() =0.1 mol,则
=0.1 mol,则
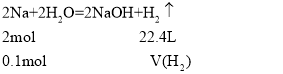
生成氢气在标准状况下的体积:V(H2)=![]() =1.12 L;
=1.12 L;
答案为1.12L;
(2)0.1molNa反应生成0.1molNaOH,氢氧化钠的质量:40g·mol-1×0.1mol=4g,所得溶液质量:2.3g+97.8g-2g·mol-1×0.05mol=100g,氢氧化钠的质量分数:ω= ![]() ×100%=
×100%=![]() ×100%=4%;
×100%=4%;
答案为4%;
(3)氢氧化钠溶液的物质的量浓度:c= ![]() =
=![]() =1 mol·L-1;
=1 mol·L-1;
答案为1mol·L-1。

练习册系列答案
 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案
相关题目
【题目】已知:H2(g)+I2(g)![]() 2HI(g)△H=-14.9kJ·mol-1。某温度下,在体积均为2.0L的甲、乙两个恒容密闭容器中充入反应物,其起始物质的量如下表所示。甲中反应达到平衡时,测得c(H2)=0.008mol·L-1。下列判断正确的是( )
2HI(g)△H=-14.9kJ·mol-1。某温度下,在体积均为2.0L的甲、乙两个恒容密闭容器中充入反应物,其起始物质的量如下表所示。甲中反应达到平衡时,测得c(H2)=0.008mol·L-1。下列判断正确的是( )
起始物质的量 | n(H2)/mol | n(I2)/mol | n(HI)/mol |
甲 | 0.02 | 0.02 | 0 |
乙 | 0.04 | 0.04 | 0 |
A. 平衡时,乙中H2的转化率是甲中的2倍
B. 平衡时,甲中混合物的颜色比乙中深
C. 平衡时,甲、乙中热量的变化值相等
D. 该温度下,反应的平衡常数K=0.25