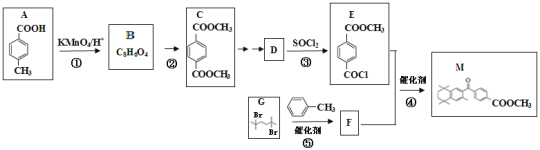
题目内容
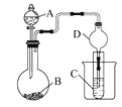
【题目】某研究小组利用如图装置探究温度对一氧化碳还原氧化铁的影响。
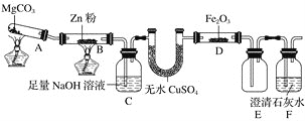
(1)MgCO3的分解产物为____________。
(2)装置C的作用是______________,处理尾气的方法为______________________。
(3)将研究小组分为两组,按如图装置进行对比实验,甲组用酒精灯、乙组用酒类喷灯对装置D加热,反应产物均为黑色粉末(纯净物)。两组分别用产物进行以下实验。已知Fe2+与K3[Fe(CN)6](铁氰化钾)溶液反应生成带有特征蓝色的铁氰化亚铁沉淀。
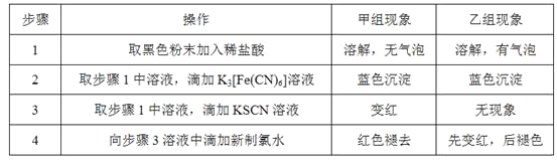
①乙组得到的黑色粉末是______________。
②甲组步骤1中反应的离子方程式为______________。
③乙组步骤4中,溶液变红的原因为______________________;溶液褪色可能的原因及其验证方法为________________________。
④从实验安全考虑,题图装置还可采取的改进措施是__________________________________。
【答案】MgO、CO2 除CO2 点燃 Fe Fe3O4+8H+=2Fe3++Fe2++4H2O Fe2+被氧化为Fe3+,Fe3+遇SCN-显红色 假设SCN-被Cl2氧化,向溶液中加入KSCN溶液,若出现红色,则假设成立 在装置BC之间添加装置E防倒吸(其他合理答案均可)
【解析】
本题的实验目的是探究温度对一氧化碳还原氧化铁的影响;观察实验装置图,以及(3)题,可以推出D为CO和Fe2O3的反应装置;A为CO2的发生装置,B为将CO2转化为CO的装置,C为CO2的除去装置,以获得纯净的CO;E为防倒吸装置(注意该装置不能用来收集CO,因为该装置收集气体时用的是向上排气法,而CO的密度比空气小,适合向下排气法),D中装有澄清石灰水,则D的作用是检验CO与Fe2O3反应的产物CO2,以证明反应发生。(3)题中,甲、乙使用的热源不同,使得反应的产物也不同,甲组现象中,步骤1无气泡生成,则说明不含Fe;步骤2说明步骤1所得的溶液中含有Fe2+,步骤3说明步骤1所得的溶液中含有Fe3+,由于CO和Fe2O3的产物是纯净物,故可以推出甲组得到的是Fe3O4;而乙组现象中,步骤1有气泡生成,则乙组得到的黑色粉末是Fe,且后续现象也说明了步骤1所得的溶液中不含Fe3+。
(1)根据CaCO3的分解反应,可以推出MgCO3的分解产物为MgO和CO2;
(2)装置C的作用是除去CO2,防止对后续实验结论产生干扰;尾气中CO为有毒气体,可以用点燃的方式处理;
(3)①乙组的现象中,步骤1中有气泡,说明黑色粉末中有Fe,由于该黑色粉末为纯净物,所以乙组得到的黑色粉末为Fe;
②甲组现象中,步骤1无气泡生成,则说明不含Fe;步骤2说明步骤1所得的溶液中含有Fe2+,步骤3说明步骤1所得的溶液中含有Fe3+,由于CO和Fe2O3的产物是纯净物,故可以推出甲组得到的是Fe3O4,则甲组步骤1中反应的离子方程式为:Fe3O4+8H+=2Fe3++Fe2++4H2O;
③乙组得到的黑色粉末为Fe,在步骤1中溶解变为Fe2+,步骤3中加入KSCN溶液,溶液不会变红,步骤4中加入新制氯水,Fe2+被氧化为Fe3+,Fe3+与SCN-结合为红色物质;红色褪去的原因可能是SCN-被氧化了,验证方法是再加入SCN-,若溶液变为红色,则说明褪色原因是SCN-被氧化;
(4)从安全的角度考虑该实验装置的不足,就是在BC之间没有安全瓶,需要在BC之间再连接一个E装置,以防止倒吸。

 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案