题目内容
16.选择下列实验方法分离物质,将分离方法的序号填在横线上.A、萃取分液法 B、加热分解 C、结晶法 D、分液法 E、蒸馏法 F、过滤法
(1)F分离饱和食盐水和沙子的混合物;
(2)A将溴水中的溴与水分离;
(3)D分离水和汽油;
(4)E分离四氯化碳(沸点为76.75℃)和甲苯(沸点为110.6℃),已知四氯化碳和甲苯互溶);
(5)C分离水和氯化钠.
分析 (1)沙子不溶于水,而NaCl溶于水;
(2)溴不易溶于水,易溶于有机溶剂;
(3)水和汽油分层;
(4)二者沸点不同,可蒸馏分离;
(5)可蒸发结晶分离.
解答 解:(1)沙子不溶于水,而NaCl溶于水,则选F分离,故答案为:F;'
(2)溴不易溶于水,易溶于有机溶剂,则选A分离,故答案为:A;
(3)水和汽油分层,可用分液的方法分离,故答案为:D;
(4)二者沸点不同,可蒸馏分离,故答案为:E;
(5)氯化钠溶于水,水易挥发,可用结晶的方法分离,故答案为:C.
点评 本题考查物质的分离、提纯,为高频考点,侧重学生的分析、实验能力的考查,注意把握物质的性质的异同以及实验的严密性、可行性的评价,难度不大.

练习册系列答案
相关题目
6.工业上用硅石为原料,制备高纯多晶硅的流程如下:

有关性质如下表:
(1)制备粗硅的化学反应方程式为SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑;硅的一种重要用途是半导体材料半导体材料(制造晶体管、集成电路)(硅整流器和太阳能电池)(变压器铁芯)等.
(2)第②步经冷凝得到的SiHCl3中含有少量SiCl4和HCl,提纯SiHCl3采用的方法是蒸馏;尾气中含有少量SiCl4和HCl,可通过NaOH(碱)溶液除去.
(3)实验室用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):

①需要加热的装置有CD(填序号);如无装置B则C中能发生的副反应方程式是SiHCl3+3H2O═H2SiO3+H2↑+3HCl.
②制备实验操作成功的关键是检查实验装置的气密性,控制好反应温度以及实验开始时先通一段时间H2,将装置中的空气排尽;反应一段时间后,装置D中观察到的现象是有固体物质生成(石英管的内壁附有灰黑色晶体).
(4)粗硅中一般含有微量铁、铝、碳、硼、磷、铜等杂质,为鉴定硅中是否含铁,将试样用稀盐酸溶解,取上层清液后加入的最佳试剂是:bd(填写字母代号).
a.碘水 b.氯水 c.NaOH溶液 d.KSCN溶液 e.Na2SO3溶液.

有关性质如下表:
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| SiHCl3 | -126.5℃ | 33.0 | 易与水强烈反应,空气中易自然 |
| SiCl4 | -70 | 57.6 | 易水解 |
| HCl | -114.2 | -84.7 |
(2)第②步经冷凝得到的SiHCl3中含有少量SiCl4和HCl,提纯SiHCl3采用的方法是蒸馏;尾气中含有少量SiCl4和HCl,可通过NaOH(碱)溶液除去.
(3)实验室用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):

①需要加热的装置有CD(填序号);如无装置B则C中能发生的副反应方程式是SiHCl3+3H2O═H2SiO3+H2↑+3HCl.
②制备实验操作成功的关键是检查实验装置的气密性,控制好反应温度以及实验开始时先通一段时间H2,将装置中的空气排尽;反应一段时间后,装置D中观察到的现象是有固体物质生成(石英管的内壁附有灰黑色晶体).
(4)粗硅中一般含有微量铁、铝、碳、硼、磷、铜等杂质,为鉴定硅中是否含铁,将试样用稀盐酸溶解,取上层清液后加入的最佳试剂是:bd(填写字母代号).
a.碘水 b.氯水 c.NaOH溶液 d.KSCN溶液 e.Na2SO3溶液.
4. 已知NH3和HCl都能用来作喷泉实验的气体,若在同温同压下用等体积烧瓶一个收集满NH3,另一个收集HCl和N2的混合气体,如图所示,喷泉实验停止后,两个烧瓶内溶液的溶质的物质的量浓度(c)和溶质的质量分数(w)关系是( )
已知NH3和HCl都能用来作喷泉实验的气体,若在同温同压下用等体积烧瓶一个收集满NH3,另一个收集HCl和N2的混合气体,如图所示,喷泉实验停止后,两个烧瓶内溶液的溶质的物质的量浓度(c)和溶质的质量分数(w)关系是( )
 已知NH3和HCl都能用来作喷泉实验的气体,若在同温同压下用等体积烧瓶一个收集满NH3,另一个收集HCl和N2的混合气体,如图所示,喷泉实验停止后,两个烧瓶内溶液的溶质的物质的量浓度(c)和溶质的质量分数(w)关系是( )
已知NH3和HCl都能用来作喷泉实验的气体,若在同温同压下用等体积烧瓶一个收集满NH3,另一个收集HCl和N2的混合气体,如图所示,喷泉实验停止后,两个烧瓶内溶液的溶质的物质的量浓度(c)和溶质的质量分数(w)关系是( )| A. | c和w都不同 | B. | c和w都相同 | C. | c相同,w不同 | D. | w相同,c不同 |
1.下列变化需要加入还原剂才能实现的是( )
| A. | 实验室用H2O2制氧气 | B. | 工业上用氨气制硝酸 | ||
| C. | 实验室用浓HNO3制NO2气体 | D. | 实验室用氯化铵制氨气 |
8.下列涉及有机物的说法正确的是( )
| A. | 石油和植物油都是混合物,且属于不同类的有机物 | |
| B. | 甲酸的性质与乙酸类似,都不能被酸性高锰酸钾溶液氧化 | |
| C. | 用酸性K2Cr2O7 溶液鉴别乙醇与乙醛溶液 | |
| D. | 纤维素、蔗糖、葡萄糖和淀粉酶在一定条件下都可发生水解反应 |
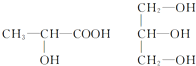 按要求完成下列问题.
按要求完成下列问题.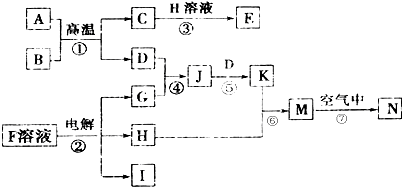
 ,N的化学式为Fe(OH)3.
,N的化学式为Fe(OH)3.