题目内容
11.向某溶液加入Ba(NO3)2溶液,产生不溶于稀HNO3的白色沉淀,则溶液中一定存在SO42-错(判断对错)分析 硫酸根离子与亚硫根离子都能与钡离子反应生成沉淀,稀HNO3能氧化亚硫酸钡生成硫酸钡白色沉淀,向某溶液加入Ba(NO3)2溶液,产生不溶于稀HNO3的白色沉淀,不一定为硫酸钡,可能是亚硫酸钡被硝酸氧化成硫酸钡沉淀.
解答 解:向某溶液加入Ba(NO3)2溶液,可能发生Ba2++SO32-=BaSO3↓,产生不溶于稀HNO3的白色沉淀,可能为3BaSO3+2HNO3=3BaSO4+2NO↑+H2O,所以白色沉淀不一定为硫酸钡,原溶液中不一定存在硫酸根离子,故该检验方法不正确,
正确检验方法为:先加入稀盐酸,无现象,可以排除银离子、碳酸根、亚硫酸根的干扰,然后再加氯化钡溶液,若产生白色沉淀,证明有SO42-存在,否则不存在硫酸根离子,
故答案为:错.
点评 本题考查了硫酸根离子的检验方法判断,题目难度不大,试题侧重基础知识的考查,注意掌握常见离子的性质及检验方法,明确检验离子存在时,必须排除干扰离子,确保检验方案的严密性.

练习册系列答案
相关题目
1.蛇纹石矿由MgO、Fe2O3、Al2O3、SiO2组成.由蛇纹石制取碱式碳酸镁实验步骤如下:

已知:
(1)蛇纹石加盐酸溶解后,溶液里除了Mg2+外,还含有的阳离子有Fe3+、Al3+.
(2)进行Ⅰ操作时,控制溶液pH=7~8(有关氢氧化物沉淀的pH见上表),Ca(OH)2不能过量,若Ca(OH)2过量可能会导致Al(OH)3溶解、Mg(OH)2沉淀.
(3)物质循环使用,能节约资源上述实验中,可以循环使用的物质是CaCO3或CO2.
(4)高温煅烧碱式碳酸镁aMgCO3•bMg(OH)2•cH2O得到MgO.取碱式碳酸镁4.66g,高温煅烧至恒重,得到固体2.00g和标准状况下CO2 0.896L,通过计算确定碱式碳酸镁的化学式为4MgCO3•Mg(OH)2•4H2O.(写出计算过程,否则不得分)

已知:
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 9.4 |
(2)进行Ⅰ操作时,控制溶液pH=7~8(有关氢氧化物沉淀的pH见上表),Ca(OH)2不能过量,若Ca(OH)2过量可能会导致Al(OH)3溶解、Mg(OH)2沉淀.
(3)物质循环使用,能节约资源上述实验中,可以循环使用的物质是CaCO3或CO2.
(4)高温煅烧碱式碳酸镁aMgCO3•bMg(OH)2•cH2O得到MgO.取碱式碳酸镁4.66g,高温煅烧至恒重,得到固体2.00g和标准状况下CO2 0.896L,通过计算确定碱式碳酸镁的化学式为4MgCO3•Mg(OH)2•4H2O.(写出计算过程,否则不得分)
2.以下有关元素性质的说法不正确的是( )
| A. | 具有下列电子排布式的原子中,①1s22s22p63s23p2②1s22s22p1${\;}^{2{2}^{3}}$③1s22s22p2④1s22s22p63s23p4 原子半径最大的是① | |
| B. | 具有下列价电子排布式的原子中,①3s23p1 ②3s23p 2 ③3s23p3 ④33s23p 4第一电离能最大是③ | |
| C. | ①Na、K、Rb ②N、P、Si ③Na、P、Cl,元素的电负性随原子序数增大而递增的是③ | |
| D. | 某主族元素气态基态原子的逐级电离能分别为738、1451、7733、10540、13630、17995、21703…,当它与氯气反应时生成的阳离子是X3+ |
6.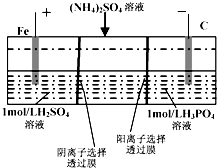 用一种阴、阳离子双隔膜三室电解槽处理废水中的NH4+,模拟装置如图所示.下列说法正确的是( )
用一种阴、阳离子双隔膜三室电解槽处理废水中的NH4+,模拟装置如图所示.下列说法正确的是( )
 用一种阴、阳离子双隔膜三室电解槽处理废水中的NH4+,模拟装置如图所示.下列说法正确的是( )
用一种阴、阳离子双隔膜三室电解槽处理废水中的NH4+,模拟装置如图所示.下列说法正确的是( )| A. | 阳极室溶液由无色变成棕黄色 | |
| B. | 电解一段时间后,阴极室溶液中的pH升高 | |
| C. | 阴极的电极反应式为:4OH--4e-═2H2O+O2↑ | |
| D. | 电解一段时间后,阴极室溶液中的溶质一定是(NH4)3PO4 |
3.如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法正确的是( )


| A. | 该硫酸的物质的量浓度为9.2mol/L | |
| B. | 常温下,1mol Cu与足量的该硫酸反应产生2g氢气 | |
| C. | 等质量的水与该硫酸混合所得溶液的物质的量浓度小于9.2mol/L | |
| D. | 配制240mL 4.6mol/L的稀硫酸需取该硫酸60mL |
20.硫酸铜溶液可以解除白磷引起的中毒,有关反应为:11P4+60CuSO4+96H2O═20Cu3P+24H3PO4+60H2SO4.下列关于该反应的说法不正确的是( )
| A. | CuSO4发生还原反应,白磷只作还原剂 | |
| B. | 氧化产物和还原产物的物质的量之比为6:5 | |
| C. | P4是一种正四面体型分子,每个P4分子中含有6个P-P非极性键 | |
| D. | 该反应中被硫酸铜氧化的白磷P4有3 mol |
1.下列各组离子在满足指定条件下,能大量共存的是( )
| A. | 无色溶液:Cu2+、K+、Cl-、CO${\;}_{3}^{2-}$ | |
| B. | 使酚酞显红色的溶液:Mg2+、Fe2+、Cl-、SO${\;}_{4}^{2-}$ | |
| C. | 加Fe粉能产生H2的溶液:Ba2+、Na+、Cl-、SO${\;}_{4}^{2-}$ | |
| D. | 加盐酸能产生气体的溶液:Na+、K+、NO${\;}_{3}^{-}$、HCO${\;}_{3}^{-}$ |
