题目内容
15.某小组同学通过对比实验了解Na2CO3和NaHCO3性质的异同,如表是他们撰写实验报告的一部分.| 实验序号 | 实验步骤(内容) | 现象 |
| ① | 在贴有标签a、b的试管中分别加入1.0 g Na2CO3固体和NaHCO3固体,观察外观. | / |
| ② | 分别滴入几滴水,振荡,摸试管底部. | 试管 a吸热现象更明显(填“a”或“b”) |
| ③ | 继续向两试管中分别加入10.0 mL水,用力振荡,观察现象. | / |
| ④ | 再分别向两试管中滴加2滴酚酞溶液,观察现象. | 溶液均变红,颜色较深的试管是 a(填“a”或“b”). |
| ⑤ | 最后分别向两溶液中滴加足量盐酸. | 红色褪去,均有无色气体产生.经计算生成气体的是a <b(填“>”“<”或“=”) |
| ⑥ | 加热大试管一段时间.(注:棉花球沾有无水硫酸铜粉末) | / |
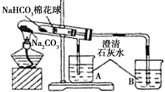
(1)请帮助该小组同学完成实验报告中的内容.
(2)已知:20℃时,Na2CO3的溶解度为20.5g.由实验③(填实验序号)现象可知,20℃时NaHCO3的溶解度小于20.5g;如果向饱和Na2CO3溶液中不断通入CO2气体,离子方程式是2Na++CO32-+CO2+H2O═2NaHCO3↓.
(3)用化学方程式说明实验⑥得出结论的原因2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O.
分析 (1)②碳酸钠、碳酸氢钠都为强碱弱酸盐,水解吸热,但碳酸钠水解程度大;
④同温下,相同浓度下,碳酸钠的水解程度大,碱性强;
⑤根据n=$\frac{m}{M}$结合方程式可知:质量相同的碳酸钠和碳酸氢钠,碳酸钠产生的CO2比碳酸氢钠产生的CO2少;
(2)溶解度的高低需要看加水溶解的情况,由实验③现象可知,饱和碳酸钠转变成了碳酸氢钠有白色沉淀生成;
(3)根据棉花球变蓝,说明产生了水,烧杯变浑浊,说明生成了CO2,因此说明碳酸钠的稳定性强于碳酸氢钠.
解答 解:(1)②碳酸钠、碳酸氢钠都为强碱弱酸盐,碳酸钠、碳酸氢钠溶于水都吸热,但碳酸钠的水解程度大于碳酸氢钠的水解程度,因此碳酸钠溶于水吸热更明显,
故答案为:a;
④碳酸钠水解的离子方程式为CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3-+OH-;碳酸氢钠水解的离子方程式为HCO3-+H2O?H2CO3-+OH-;同温下,相同浓度下,碳酸钠的pH大于碳酸氢钠的,酚酞遇碱变红,碱性越强,红色越深,因此颜色较深的试管是a,
故答案为:a;
⑤Na2CO3+2HCl=2NaCl+CO2↑+H2O,NaHCO3+HCl=NaCl+CO2↑+H2O,质量相同的碳酸钠和碳酸氢钠,假设质量都为m,则放出二氧化碳的物质的量分别为:$\frac{m}{106}$mol、$\frac{m}{84}$mol,
碳酸钠产生的CO2比碳酸氢钠产生的CO2少,
填答案为:<;
(2)溶解度的高低需要看加水溶解的情况,因此实验③说明了溶解度的高低;Na2CO3+CO2+H2O=2NaHCO3↓,离子反应为:2Na++CO32-+CO2+H2O═2NaHCO3↓,饱和碳酸钠转变成了碳酸氢钠,因为碳酸钠的溶解度大于碳酸氢钠的溶解度,因此有白色沉淀生成,
故答案为:③;2Na++CO32-+CO2+H2O═2NaHCO3↓;
(3)根据实验现象,棉花球变蓝,说明产生了水,烧杯变浑浊,说明生成了CO2,说明碳酸钠的稳定性强于碳酸氢钠,因此反应方程式:2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3 +CO2↑+H2O,
故答案为:2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3 +CO2↑+H2O.
点评 本题考查Na2CO3和NaHCO3化学性质差异,侧重热稳定性、溶解性的比较,把握碳酸氢钠受热易分解及对比性为解答的关键,侧重对学生能力的培养和训练,有利于培养学生灵活运用知识解答问题的能力,本题综合性较强,题目难度中等.

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案| A. | pH=3的溶液中:Na+、NO3-、Fe2+、SO42- | |
| B. | 加入铝粉能产生氢气的溶液中:NH4+、CH3COO-、SO42-、NO3- | |
| C. | 某酸性溶液中Na+、ClO?、SO42?、I? | |
| D. | 在0.1mol•L-1 AlC13溶液中:H+、Na+、Cl-、NO3- |
| A. | 0.1 mol CH4含有的电子数为NA | |
| B. | 1 L 1 mol/L的AlCl3溶液中含有NA个Al3+ | |
| C. | 7.8g过氧化钠所含阴离子数为0.2 NA | |
| D. | 标准状况下,22.4 L 己烷中共价键数为19NA |
| A. | 配制Fe(NO3)2溶液时,为了防止Fe2+水解可向溶液中加入适量的稀硝酸 | |
| B. | 向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生,则Ksp(BaCO3)<Ksp(BaSO4) | |
| C. | pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 | |
| D. | 已知I2可溶于KI形成KI3,向两支盛有KI3溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有黄色沉淀,说明KI3溶液中存在平衡:I3-?I2+I- |
| A. | 试管、锥形瓶 | B. | 烧瓶、蒸发皿 | C. | 坩埚、蒸发皿 | D. | 试管、烧杯 |
| A. | K+MnO4- Cl- SO42- | B. | Na+K+NH4+Ba2+ | ||
| C. | Na+HCO3- NO3- SO42- | D. | Na+SO42- S2- Cl- |
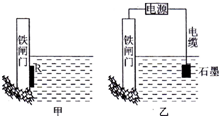 钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的$\frac{1}{4}$.为了降低某水库的铁闸门被腐蚀的速率,可以采用图甲所示甲的方案,属于原电池原理(填“原电池”或“电解池”);图乙中乙方案也可降低铁闸门腐蚀速率,称为外加电流的阴极保护法保护法.
钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的$\frac{1}{4}$.为了降低某水库的铁闸门被腐蚀的速率,可以采用图甲所示甲的方案,属于原电池原理(填“原电池”或“电解池”);图乙中乙方案也可降低铁闸门腐蚀速率,称为外加电流的阴极保护法保护法.