题目内容
7.下列各组离子中,在碱性溶液里能大量共存,并且溶液为无色透明的是( )| A. | K+MnO4- Cl- SO42- | B. | Na+K+NH4+Ba2+ | ||
| C. | Na+HCO3- NO3- SO42- | D. | Na+SO42- S2- Cl- |
分析 碱性溶液中含大量的氢氧根离子,根据离子之间不能结合生成沉淀、气体、水等,不能发生氧化还原反应等,则离子大量共存,并结合离子的颜色来解答.
解答 解:碱性溶液中含大量的氢氧根离子,
A.MnO4-为紫色,与无色不符,故A错误;
B.碱性溶液中不能大量存在NH4+,故B错误;
C.碱性溶液中不能大量存在HCO3-,故C错误;
D.碱性溶液中该组离子之间不反应,可大量共存,故D正确;
故选D.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应的离子共存考查,题目难度不大.

练习册系列答案
相关题目
17.镍是有机合成的重要催化剂.某化工厂有含镍催化剂废品(主要成分是镍,杂质是铁、铝单质及其化合物,少量难溶性杂质).某学习小组设计如图流程利用含镍催化剂废品制备硫酸镍晶体: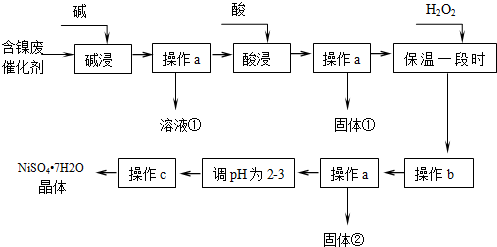
几种难溶碱开始沉淀和完全沉淀的pH如表:
回答下列问题:
(1)溶液①中含金属元素的离子是AlO2-.
(2)用离子方程式表示加入双氧水的目的2Fe2++H2O2+2H+=2Fe3++2H2O.双氧水可以用下列物质替代的是A.
A.氧气 B.高锰酸钾 C.氯气 D.硝酸
(3)取2.0000g硫酸镍晶体样品溶于蒸馏水,用0.2mol•L-1的EDTA(Na2H2Y)标准溶液滴定至终点,消耗EDTA标准溶液为34.50mL.滴定反应为Ni2++H2Y2-=NiY2-+2H+.计算样品纯度为97.0%.(已知,NiSO4•7H2O相对分子质量为281,不考虑杂质反应).
(4)操作b调节溶液范围为3.2-7.1,其目的是除去Fe3+.固体②的化学式为Fe(OH)3.
(5)操作a和c需要使用的仪器除铁架台(带铁圈)、烧杯、酒精灯、玻璃棒外还需要的主要玻璃仪器是漏斗.上述流程中,“酸浸”时所加入的酸是H2SO4(填化学式).

几种难溶碱开始沉淀和完全沉淀的pH如表:
| 沉淀物 | 开始沉淀 | 完全沉淀 |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ni(OH)2 | 7.1 | 9.2 |
(1)溶液①中含金属元素的离子是AlO2-.
(2)用离子方程式表示加入双氧水的目的2Fe2++H2O2+2H+=2Fe3++2H2O.双氧水可以用下列物质替代的是A.
A.氧气 B.高锰酸钾 C.氯气 D.硝酸
(3)取2.0000g硫酸镍晶体样品溶于蒸馏水,用0.2mol•L-1的EDTA(Na2H2Y)标准溶液滴定至终点,消耗EDTA标准溶液为34.50mL.滴定反应为Ni2++H2Y2-=NiY2-+2H+.计算样品纯度为97.0%.(已知,NiSO4•7H2O相对分子质量为281,不考虑杂质反应).
(4)操作b调节溶液范围为3.2-7.1,其目的是除去Fe3+.固体②的化学式为Fe(OH)3.
(5)操作a和c需要使用的仪器除铁架台(带铁圈)、烧杯、酒精灯、玻璃棒外还需要的主要玻璃仪器是漏斗.上述流程中,“酸浸”时所加入的酸是H2SO4(填化学式).
18.下列操作中不正确的是( )
| A. | 过滤时玻璃棒与三层滤纸的一边接触 | |
| B. | 过滤时漏斗下方紧贴烧杯内壁 | |
| C. | 加热试管内物质时,试管底部与酒精灯灯芯接触 | |
| D. | 加热氯酸钾制取氧气结束时,先从水槽中移出导气管,再熄灭酒精灯 |
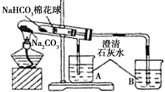
15.某小组同学通过对比实验了解Na2CO3和NaHCO3性质的异同,如表是他们撰写实验报告的一部分.
(1)请帮助该小组同学完成实验报告中的内容.
(2)已知:20℃时,Na2CO3的溶解度为20.5g.由实验③(填实验序号)现象可知,20℃时NaHCO3的溶解度小于20.5g;如果向饱和Na2CO3溶液中不断通入CO2气体,离子方程式是2Na++CO32-+CO2+H2O═2NaHCO3↓.
(3)用化学方程式说明实验⑥得出结论的原因2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O.
| 实验序号 | 实验步骤(内容) | 现象 |
| ① | 在贴有标签a、b的试管中分别加入1.0 g Na2CO3固体和NaHCO3固体,观察外观. | / |
| ② | 分别滴入几滴水,振荡,摸试管底部. | 试管 a吸热现象更明显(填“a”或“b”) |
| ③ | 继续向两试管中分别加入10.0 mL水,用力振荡,观察现象. | / |
| ④ | 再分别向两试管中滴加2滴酚酞溶液,观察现象. | 溶液均变红,颜色较深的试管是 a(填“a”或“b”). |
| ⑤ | 最后分别向两溶液中滴加足量盐酸. | 红色褪去,均有无色气体产生.经计算生成气体的是a <b(填“>”“<”或“=”) |
| ⑥ | 加热大试管一段时间.(注:棉花球沾有无水硫酸铜粉末) | / |

(1)请帮助该小组同学完成实验报告中的内容.
(2)已知:20℃时,Na2CO3的溶解度为20.5g.由实验③(填实验序号)现象可知,20℃时NaHCO3的溶解度小于20.5g;如果向饱和Na2CO3溶液中不断通入CO2气体,离子方程式是2Na++CO32-+CO2+H2O═2NaHCO3↓.
(3)用化学方程式说明实验⑥得出结论的原因2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O.
2. 已知:CO(g)+H2O(g)?CO2(g)+H2(g)△H=Q,其平衡常数随温度变化如下表所示:
已知:CO(g)+H2O(g)?CO2(g)+H2(g)△H=Q,其平衡常数随温度变化如下表所示:
请回答下列问题:
(1)上述反应的化学平衡常数表达式为$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$.该反应的Q<0(填“>”或“<”).
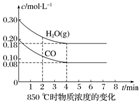
(2)850℃时在体积为10L的反应器中,通入一定量的CO和H2O(g),发生上述反应,CO和H2O(g)的物质的量浓度变化如图所示,则0~4min时平均反应速率v(CO)=0.03mol/(L•min).
(3)若在500℃时进行.且CO、H2O(g)的起始浓度均为0.020mol•L-1,该条件下,CO的最大转化率为75%.
(4)若在850℃时进行,设起始时CO和H2O(g)共为1mol,其中H2O(g)的体积分数为x,平衡时CO的转化率为y,试推导y与x之间的关系x=y.
 已知:CO(g)+H2O(g)?CO2(g)+H2(g)△H=Q,其平衡常数随温度变化如下表所示:
已知:CO(g)+H2O(g)?CO2(g)+H2(g)△H=Q,其平衡常数随温度变化如下表所示:| 温度/℃ | 400 | 500 | 850 |
| 平衡常数 | 9.94 | 9 | 1 |
(1)上述反应的化学平衡常数表达式为$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$.该反应的Q<0(填“>”或“<”).
(2)850℃时在体积为10L的反应器中,通入一定量的CO和H2O(g),发生上述反应,CO和H2O(g)的物质的量浓度变化如图所示,则0~4min时平均反应速率v(CO)=0.03mol/(L•min).
(3)若在500℃时进行.且CO、H2O(g)的起始浓度均为0.020mol•L-1,该条件下,CO的最大转化率为75%.
(4)若在850℃时进行,设起始时CO和H2O(g)共为1mol,其中H2O(g)的体积分数为x,平衡时CO的转化率为y,试推导y与x之间的关系x=y.
12.设NA为阿伏伽德常数的值,下列说法正确的是( )
| A. | 24g镁的最外层电子数为NA | |
| B. | 常温常压下,18g H2O含有的原子总数为3 NA | |
| C. | 标准状况下,11.2LCH3CH2OH中含有分子的数目为0.5 NA | |
| D. | 常温常压下,2.24LCO和CO2混合气体中含有的碳原子数目为0.1 NA |
19.硫有多种单质.S(单斜)和S(正交)是其中的两种同素异形体.已知:
①S(单斜,s)+O2(g)═SO2(g)△H1=-297.16kJ•mol-1
②S(正交,s)+O2(g)═SO2(g)△H2=-296.83kJ•mol-1
③S(单斜,s)═S(正交,s)△H3
下列说法不正确的是( )
①S(单斜,s)+O2(g)═SO2(g)△H1=-297.16kJ•mol-1
②S(正交,s)+O2(g)═SO2(g)△H2=-296.83kJ•mol-1
③S(单斜,s)═S(正交,s)△H3
下列说法不正确的是( )
| A. | △H3<0 | |
| B. | 正交硫比单斜硫稳定 | |
| C. | 单斜硫转化为正交硫是吸热反应 | |
| D. | 质量相等时,单斜硫能量比正交硫能量高 |
16.CO2、H2和CO组成的混合气体在同温同压下与氮气的密度相同.则该混合气体中CO2、H2和CO的体积比不可能的为( )
| A. | 13:8:29 | B. | 39:24:13 | C. | 22:11:14 | D. | 26:16:57 |
17.下列有关离子方程式与所述事实相符且正确的是( )
| A. | Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++2OH-+2H++SO${\;}_{4}^{2-}$═BaSO4↓+2H2O | |
| B. | 用氯化铁溶液和沸水反应制取氢氧化铁胶体:Fe3++3H2O(沸水)═Fe(OH)3↓+3H+ | |
| C. | 钠与水反应:Na+2H2O=Na++2OH-+H2↑ | |
| D. | 澄清石灰水与稀盐酸反应:Ca(OH)2+2H+=Ca2++2H20 |