题目内容
18.已知4NH3+5O2=4NO+6H2O,若反应速率分别用 v(NH3)、v(O2)、v(NO)、v(H2O)[单位均为mol•(L•s)-1]表示,则正确的是( )| A. | $\frac{4}{5}$v(NH3)=v(O2) | B. | $\frac{4}{5}$v(O2)=v(NO) | C. | $\frac{5}{6}$ v(O2)=v(H2O) | D. | $\frac{2}{3}$v(NH3)=v(H2O) |
分析 同一化学反应、同一时间段内,各物质的反应速率之比等于计量数之比,据此分析解答.
解答 解:同一化学反应、同一时间段内,各物质的反应速率之比等于计量数之比,则:
A.v(NH3):v(O2)=4:5,$\frac{5}{4}$v(NH3)=v(O2),故A错误.
B.v(O2):v(NO)=5:4,$\frac{4}{5}$v(O2)=v(NO),故B正确;
C.v(O2):v(H2O)=5:6,$\frac{6}{5}$v(O2)=v(H2O),故C错误;
D.v(NH3):v(H2O)=4:6=2:3,$\frac{3}{2}$v(NH3)=v(H2O),故D错误,
故选B.
点评 本题考查化学反应速率的有关计算,比较基础,注意速率计算常用方法有定义法与化学计量数法,同一反应,不同的物质来表示化学反应速率,数值不同,但意义相同,且化学反应速率之比等于化学计量数之比.

练习册系列答案
相关题目
8.关于长式元素周期表的说法中不正确的是( )
| A. | 共有18个纵列,16个族 | |
| B. | 位于金属区和非金属区交界处的金属元素的族序数等于周期序数 | |
| C. | 过渡元素全是金属元素 | |
| D. | 第ⅢA族位于第3纵列 |
9.下列离子方程式正确的是( )
| A. | 氨水与亚硫酸溶液混合:NH3•H2O+H+═NH4++H2O | |
| B. | 将少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=2HClO+CaSO3↓ | |
| C. | 足量铁屑溶于稀硫酸:2Fe+6H+=2Fe3++3H2↑ | |
| D. | 将Cl2通入FeSO4溶液中:Cl2+2Fe2+═2Fe3++2 Cl- |
13.Ⅰ.在实验室利用下列装置,可制备某些气体并验证其化学性质.
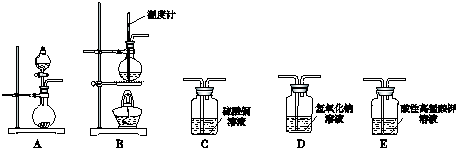
完成下列表格:
(3)D装置中氢氧化钠溶液的作用除二氧化碳和二氧化硫
Ⅱ.工业上用乙烯和氯气为原料,经下列各步合成聚氯乙烯(PVC):
乙烯$→_{(1)}^{一定条件}$甲$→_{(2)}^{一定条件}$乙$→_{(3)}^{一定条件}$PVC
甲的结构简式是CH2ClCH2Cl;反应(3)的化学方程式是nH2C=CHCl$\stackrel{催化剂}{→}$ .
.

完成下列表格:
| 序号 | 气体 | 装置连接顺序(填字母) | 制备反应的化学方程式 |
| (1) | 乙烯 | B→D→E | CH3-CH2-OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O |
| (2) | 乙炔 | A→C→E | CaC2+2H2O→CH≡CH↑+Ca(OH)2 |
Ⅱ.工业上用乙烯和氯气为原料,经下列各步合成聚氯乙烯(PVC):
乙烯$→_{(1)}^{一定条件}$甲$→_{(2)}^{一定条件}$乙$→_{(3)}^{一定条件}$PVC
甲的结构简式是CH2ClCH2Cl;反应(3)的化学方程式是nH2C=CHCl$\stackrel{催化剂}{→}$
 .
.
3.某物质化学式为NH5,常温下是固态,能与水剧烈反应放出两种气体.在NH5中的各原子均具有稀有气体的稳定结构,则下列对NH5的描述中正确的是( )
| A. | NH5由分子构成 | B. | NH5属于离子化合物 | ||
| C. | NH5中N的化合价为-5价 | D. | NH5与水的反应是非氧化还原反应 |
7.下表是五种短周期元素的原子半径,最高正价及负化合价,下列叙述正确的是( )
| 元素代号 | L | M | Q | R | T |
| 原子半径/mm | 0.160 | 0.089 | 0.143 | 0.102 | 0.074 |
| 化合价 | +2 | +2 | +3 | +6,-2 | -2 |
| A. | L、M的单质与稀盐酸反应速率L<M | |
| B. | Q、T两元素间可形成两性化合物 | |
| C. | R、T两元素的氢化物分子间能形成氢键 | |
| D. | L、R两元素的简单离子的核外电子数可能相等 |
8.一定条件下反应2AB(g)?A2(g)+B2(g)达到平衡状态的标志是( )
| A. | 单位时间内生成nmolA2,同时消耗2n molAB | |
| B. | 容器中各组分的体积分数不随时间变化容器内 | |
| C. | AB的消耗速率等于A2的消耗速率 | |
| D. | 3种气体AB、A2、B2共存 |

 .
.