题目内容
有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期, Z、M同主族;X+与M2—具有相同的电子层结构;离子半径:Z2—>W—;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。下列说法中,正确的是
| A.X、M两种元素只能形成X2M型化合物 |
| B.由于W、Z、M元素的氢化物相对分子质量依次减小,所以其沸点依次降低 |
| C.元素Y、Z、W的单质晶体属于同种类型的晶体 |
| D.元素W和M的某些单质可作为水处理中的消毒剂 |
D
解析试题分析:解:由Y的单质晶体熔点高、硬度大,是一种重要的半导体材料可知Y是硅元素,即X、Y、Z、W属于第三周期,由离子半径:Z2->W-可知X、Z、W分别属于钠、硫、氯元素,又因为Z、M同主族且X+与M2-具有相同的电子层结构,则M是氧元素;A、因钠和氧还可以形成Na2O2,故A错误;B、因水分子中存在氢键,所以水的沸点最高,沸点为H2O>HCl>H2S,故B错误;C、元素Y、Z、W的单质晶体分别属于原子晶体、分子晶体、分子晶体,故C错误;D、Cl2和O3都具有强氧化性,则可以作为消毒剂,故D正确;故选:D.
考点:本题考查了位置、结构、性质的关系和应用,寻找本题的突破点为Y是解答本题的关键,然后利用元素化合物知识来解答即可。

元素X形成的简单离子与钙离子的核外电子排布相同,且X的简单离子半径大于氯离子的半径,则X元素为
| A.Mg | B.S | C.Ar | D.K |
现有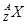 和
和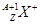 两种粒子,下列叙述正确的是
两种粒子,下列叙述正确的是
| A.质子数相等 |
| B.X元素的质量数为A |
C.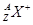 一定具有稀有气体元素原子的核外电子排布 一定具有稀有气体元素原子的核外电子排布 |
| D.它们的化学性质几乎完全相同 |
X、Y、Z、W是短周期元素,X元素原子的最外层未达到8电子稳定结构,工业上通过分离液态空气获得其单质;Y元素原子最外电子层上s、p电子数相等;Z元素+2价阳离子的核外电子排布与氖原子相同;W元素原子的M层有1个未成对的p电子。下列有关这些元素性质的说法一定正确的是( )
| A.X元素的氢化物的水溶液显碱性 |
| B.Z元素的离子半径大于W元素的离子半径 |
| C.Z元素的单质在一定条件下能与X元素的单质反应 |
| D.Y元素最高价氧化物的晶体具有很高的熔点和沸点 |
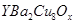 (Y为元素钇)是磁悬浮列车中的重要超导材料,关于
(Y为元素钇)是磁悬浮列车中的重要超导材料,关于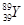 的说法不正确的是( )
的说法不正确的是( )
| A.属于金属元素 | B.质子数与中子数之差为50 |
| C.原子的核外电子数是39 | D.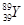 和 和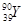 是两种不同的核素 是两种不同的核素 |
下列排列的顺序正确的是
| A.热稳定性:HCl>PH3>H2S | B.碱性:NaOH< Mg(OH)2<Al(OH)3 |
| C.原子半径:O>S>Na | D.结合氢离子能力:CO32->HCO3->SO42- |
X、Y、Z、W为四种短周期主族元素,其中X、Z同族,Y、Z同周期,W是短周期主族元
素中原子半径最大的,X原子最外层电子数是核外电子层数的3倍,Y的最高正价与最低负价代数和为6。下列说法正确的是( )
| A.Y元素最高价氧化物对应的水化物化学式H2YO4 |
| B.原子半径由大到小的顺序为:Z>Y> W |
| C.X、Z两种元素的气态氢化物中,Z的气态氢化物较稳定 |
| D.X与W形成的两种化合物中,阴、阳离子物质的量之比均为1:2 |
元素周期律和元素周期表是学习化学的重要工具,下列说法中,不正确的是
| A.HF、HCI、HBr、HI的还原性依次增强,热稳定性依次减弱 |
| B.P、S、CI得电子能力和最高价氧化物对应水化物的酸性均依次增强 |
| C.IA族的金属单质与水反应比同周期IIA族的金属单质剧烈 |
| D.除稀有气体外,第三周期元素的原子半径和离子半径随原子序数的增加而减小 |