题目内容
现有100mL AlCl3与MgSO4的混合溶液,分成两等份。
(1)向其中一份中加入10mL 4mol/L的氨水,恰好完全反应,其中AlCl3与氨水反应的离子方程式是 。继续加入l mol/L NaOH溶液至10mL时,沉淀不再减少,沉淀减少的离子方程式是 ,剩余的沉淀的物质的量是 。
(2)向另一份中加入a mL 0.1mol/LBaCl2溶液能使SO42-沉淀完全,a= 。
(1)向其中一份中加入10mL 4mol/L的氨水,恰好完全反应,其中AlCl3与氨水反应的离子方程式是 。继续加入l mol/L NaOH溶液至10mL时,沉淀不再减少,沉淀减少的离子方程式是 ,剩余的沉淀的物质的量是 。
(2)向另一份中加入a mL 0.1mol/LBaCl2溶液能使SO42-沉淀完全,a= 。
(8分)
(1)A13++3NH3·H2O=Al(OH)3↓+3NH4+(2分)
Al(OH)3+4OH-= [Al(OH)4]-(2分)
0.005 mol(2分)
(2)50(2分)
(1)A13++3NH3·H2O=Al(OH)3↓+3NH4+(2分)
Al(OH)3+4OH-= [Al(OH)4]-(2分)
0.005 mol(2分)
(2)50(2分)
试题分析:(1)AlCl3与MgSO4的混合溶液都和氨水发生反应生成沉淀Al(OH)3和Mg(OH)2,且沉淀与氨水不再反应,AlCl3与氨水反应的离子方程式是A13++3NH3·H2O=Al(OH)3↓+3NH4+。10mL 4mol/L 的氨水,物质的量为0.01L×4 mol/L=0.04mol。
Al(OH)3会和NaOH溶液反应,沉淀减少,离子方程式为Al(OH)3+4OH-= [Al(OH)4]-。加入的NaOH的物质的量为l mol/L×0.01L=0.01mol,即AlCl3的物质的量为0.01mol。MgSO4为0.005mol。
根据化学方程式的计算,剩余的沉淀即Mg(OH)2的物质的量是0.005 mol。
(2)MgSO4为0.005mol,根据质量守恒定律及化学方程式的计算得,SO42-的物质的量也为0.005mol,故a=50。
点评:本题考查金属镁、金属铝的化合物的有关性质,注意氢氧化铝能和强碱反应是解题的关键所在,难度中。

练习册系列答案
相关题目
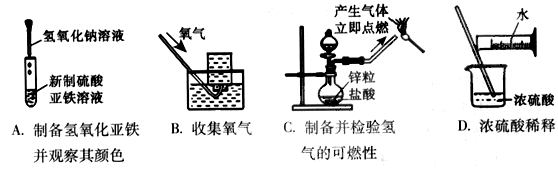
 操作正确且能达到目的的是
操作正确且能达到目的的是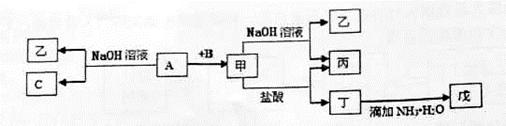

 丙转化的离子方程式 :________________________ 。
丙转化的离子方程式 :________________________ 。