题目内容
下列有关金属及其合金的说法不正确的是( )
| A.目前我国流通的硬币是由铁、铜、铝的合金材料制造的 |
| B.铝在氧气中燃烧放出大量的热和耀眼的白光 |
| C.铝热反应可用于焊接钢轨 |
| D.铝锅表面有致密的氧化膜保护,可以蒸煮碱性食物 |
D
试题分析:D、铝锅表面有致密的氧化膜为氧化铝,氧化铝为两性氧化物,既可以与酸反应也可以与碱反应,故错。故选D。
点评:本考点主要考查纯金属与合金的性质,金属的三个化学性质要记牢.合金概念的三个特点要记牢,还要理解合金的性质,即合金的硬度大,熔点低、耐腐蚀.本考点基础性强,比较好把握。

练习册系列答案
相关题目
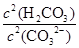 填(“变大”、“变小”或“不变”)
填(“变大”、“变小”或“不变”) 测定生成的气体在标准状况下的体积
测定生成的气体在标准状况下的体积 测定生成的气体在标准状况下的体积
测定生成的气体在标准状况下的体积 溶液
溶液 过滤,测定得到沉淀的质量
过滤,测定得到沉淀的质量