题目内容
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A.1.0mol/L的KNO3溶液:H+、Fe2+、Cl、![]()
B.甲基橙呈红色的溶液:![]() 、Ba2+、
、Ba2+、![]() 、Cl
、Cl
C.pH=12的溶液:K+、Na+、CH3COO、Br
D.使KSCN显血红色的溶液:![]() 、Mg2+、I、Cl
、Mg2+、I、Cl
【答案】C
【解析】
A.H+、Fe2+、![]() 之间能够发生氧化还原反应,不能大量共存,A选项错误;
之间能够发生氧化还原反应,不能大量共存,A选项错误;
B.使甲基橙呈红色的溶液为酸性溶液,溶液中存在大量H+,H+与![]() 在溶液中能够反应,且
在溶液中能够反应,且![]() 与
与![]() 会发生双水解,不能大量共存,B选项错误;
会发生双水解,不能大量共存,B选项错误;
C.pH=12的溶液显碱性,OH-与K+、Na+、CH3COO-、Br-不反应,且K+、Na+、CH3COO-、Br-之间也不反应,可大量共存,C选项正确;
D.滴加几滴KSCN溶液显血红色的溶液中含有Fe3+,Fe3+、I-能够发生氧化还原反应,不能大量共存,D选项错误;
答案选C。

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案【题目】钛被誉为“21世纪的金属”,可呈现多种化合价,其中以+4价的Ti最为稳定。回答下列问题:
(1)基态Ti原子的价电子轨道表示式为 ___。
(2)已知电离能:I2(Ti)=1 310 kJ/mol,I2(K)=3051 kJ/mol,I2(Ti)<I2(K),其原因为_____________
(3)钛某配合物可用于催化环烯烃聚合,其结构如下图所示:
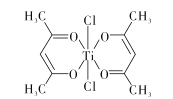
①钛的配位数为 ___,碳原子的杂化类型____。
②该配合物中存在的化学键有____(填字母代号)。
A.离子键 B.配位键 C.金属键 D.共价键 e.氢键
(4)钛与卤素形成的化合物熔沸点如下表所示:
TiCl4 | TiBr4 | TiI4 | |
熔点/℃ | -24.1 | 38.3 | 155 |
沸点/℃ | 136.5 | 233.5 | 377 |
分析TiCl4、TiBr4、TiI4的熔点和沸点呈现一定变化规律的原因是_________________
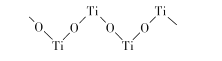
(5)已知TiO2与浓硫酸反应生成硫酸氧钛,硫酸氧钛晶体中阳离子为链状聚合形式的离子,结构如图所示,该阳离子化学式为____,阴离子的空间构型为__________ .
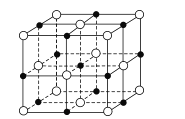
(6)已知TiN晶体的晶胞结构如图所示,若该晶胞的密度为ρg/cm3,阿伏加德罗常数值为NA,则晶胞中Ti原子与N原子的最近距离为____pm(用含p、NA的代数式表示)。